
科目: 來源: 題型:
【題目】水溶液中的離子平衡是中學學習的一個重要內容。
(1)甲同學用pH試紙分別測定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。請寫出pH試紙使用方法:_____根據測量結果,甲推測等濃度的NaOH溶液、CH3COOH溶液中,由水電離出的H+濃度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同學分別取了pH=3的CH3COOH溶液和HCl溶液各10mL,測量導電能力發現HCl溶液導電能力______________CH3COOH溶液導電能力(填“大于”“小于”或“等于”)。然后分別加水稀釋到100 mL后,再次測量,稀釋后的HCl溶液導電能力______________CH3COOH溶液導電能力(填“大于”“小于”或“等于”)
(3)丙同學查閱資料發現,人體血液里存在重要的酸堿平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:
HCO3-,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人體血液中,HCO3-的水解程度____電離程度(填“>”、“<”或“=”);
②人體血液酸中毒時,可注射________(填選項)緩解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等濃度的Na2CO3和NaHCO3的混合溶液中各離子濃度大小順序___________
④已知25 ℃時,CO32-水解反應的平衡常數Kh=![]() =
=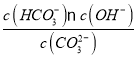 =2×10-4 mol/L,當溶液中c(HCO3-)︰c( CO32-)=2:1時,溶液的pH=________;
=2×10-4 mol/L,當溶液中c(HCO3-)︰c( CO32-)=2:1時,溶液的pH=________;
(4)丁同學探究難溶電解質在水溶液中的性質,查閱資料發現25 ℃時,AgCl的Ksp=1.8×10-10,該溫度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液體積的變化)。平衡后,若向該體系中再加入少量AgCl固體,則c(Cl-)_____(填“增大”或“減小”或“不變”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】設nA為阿伏加德羅常數的數值,下列敘述正確的是
A.1molL-1 MgCl2溶液中的Mg2+數為NA
B.1 mol Na2O2固體中含陰離子總數為2NA
C.5 g質量分數為46%的乙醇溶液中,氫原子的總數為0.6 NA
D.100 mL 12molL-1濃鹽酸與足量MnO2加熱反應,轉移電子數為1.2NA
查看答案和解析>>
科目: 來源: 題型:
【題目】(10分)鉛蓄電池是常用的化學電源,其電極材料分別是Pb和PbO2,電解液為稀硫酸。放電時,該電池總反應式為:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。請根據上述情況判斷:
2PbSO4+2H2O。請根據上述情況判斷:
(1)該蓄電池的負極材料是_________,放電時發生_________(填“氧化”或“還原”)反應。
(2)該蓄電池放電時,電解質溶液的酸性_________(填“增大”、“減小”或“不變”),電解質溶液中陰離子移向_________(填“正”或“負”)極。
(3)已知硫酸鉛為不溶于水的白色固體,生成時附著在電極上。試寫出該電池放電時,正極的電極反應_______________________________________(用離子方程式表示)。
(4)氫氧燃料電池具有啟動快、效率高等優點,其能量密度高于鉛蓄電池。若電解質為KOH溶液,則氫氧燃料電池的負極反應式為____________________。該電池工作時,外電路每流過1×103 mol e-,消耗標況下氧氣_________m3。
查看答案和解析>>
科目: 來源: 題型:
【題目】下圖為某有機化合物的結構簡式:
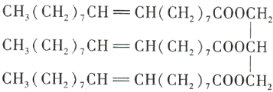
請回答下列問題。
(1)該有機化合物含有的官能團有_______________(填名稱)。
(2)該有機化合物的類別是_______________(填字母序號,下同)。
A.烯烴 B.酯 C.油脂 D.羧酸
(3)將該有機化合物加入水中,則該有機化合物_______________。
A.與水互溶 B.不溶于水,水在上層 C.不溶于水,水在下層
(4)該物質是否有固定熔點、沸點?_______________(填“是”或“否”)
(5)能與該有機化合物反應的物質有_______________。
A.![]() 溶液 B.碘水 C.乙醇 D.乙酸 E.
溶液 B.碘水 C.乙醇 D.乙酸 E.![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】一種新型燃料電池,一極通入空氣,另一極通入丁烷氣體,電解質是摻雜氧化釔![]() 的氧化鋯
的氧化鋯![]() 晶體,在熔融狀態下能傳導
晶體,在熔融狀態下能傳導![]() 。對該燃料的說法正確的是( )
。對該燃料的說法正確的是( )
A.在熔融電解質中,![]() 由負極移向正極
由負極移向正極
B.電池的總反應是:2C4H10+13O2![]() 8CO2+10H2O
8CO2+10H2O
C.通入空氣的一極是正極,電極反應為:![]()
D.通入丁烷的一極是正極,電極反應為:![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學用食用油進行實驗,以下是實驗操作和現象:
實驗操作 | 將食用油滴入水中 | 向食用油中滴加溴水 | 將少量食用油與純堿(主要成分是 |
實驗現象 | 食用油浮在水面上 | 溴水褪色 | 分層現象消失 |
下列關于食用油的實驗結論不正確的是( )
A.食用油的密度比水小
B.食用油中含碳碳不飽和鍵
C.食用油在堿性條件下會水解生成可溶于水的物質
D.食用油是一種有機酸
查看答案和解析>>
科目: 來源: 題型:
【題目】分析如圖所示的四個原電池裝置,其中結論正確的是
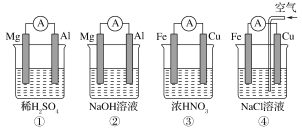
A. ①②中Mg作負極,③④中Fe作負極
B. ②中Mg作正極,正極反應式為6H2O+6e-==6OH-+3H2↑
C. ③中Fe作負極,電極反應式為Fe-2e-==Fe2+
D. ④中Cu作正極,電極反應式為2H++2e-==H2↑
查看答案和解析>>
科目: 來源: 題型:
【題目】油脂是油與脂肪的總稱,它是多種高級脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途與其含有的碳碳不飽和鍵(![]() )有關的是
)有關的是
A. 衣服上的油脂可用汽油洗去
B. 適量攝入油脂,有利于人體吸收多種脂溶性維生素和胡蘿卜素
C. 植物油通過氫化可以制造植物奶油(人造奶油)
D. 脂肪是有機體組織里儲存能量的重要物質
查看答案和解析>>
科目: 來源: 題型:
【題目】二甲醚(DME)被譽為“21世紀的清潔燃料”。由合成氣制備二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列問題:
(1)則反應3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,該反應的平衡常數K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,該反應的平衡常數K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3產率的有__________。
A.使用過量的CO B.升高溫度 C.增大壓強
(3)一定溫度下,0.2molCO和0.1molH2O通入2L恒容密閉容器中,發生反應③,5分鐘時達到化學平衡,平衡后測得H2的體積分數為0.1。則5分鐘v(H2O)=_______________,CO的轉化率α(CO)=___________。
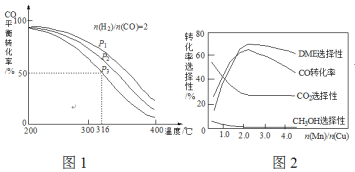
(4)將合成氣以![]() =2通入1 L的反應器中,一定條件下發生反應:4H2(g)+2CO(g)
=2通入1 L的反應器中,一定條件下發生反應:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡轉化率隨溫度、壓強變化關系如圖1所示,下列說法正確的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡轉化率隨溫度、壓強變化關系如圖1所示,下列說法正確的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃時,起始時![]() =3,則平衡時,α(CO)小于50%
=3,則平衡時,α(CO)小于50%
(5)采用一種新型的催化劑(主要成分是Cu-Mn的合金),利用CO和H2制備二甲醚(DME)。觀察圖2回答問題。催化劑中![]() 約為___________時最有利于二甲醚的合成。
約為___________時最有利于二甲醚的合成。
查看答案和解析>>
科目: 來源: 題型:
【題目】向1LFeBr2溶液中,通入1.12L(標態下)的Cl2,測得溶液中c(Br-)=3c(Cl-),反應過程中溶液的體積變化不計,則下列說法中正確的是
A. 原溶液的濃度為0.1mol/L B. 反應后溶液中c(Fe3+)=0.1mol/L
C. 反應后溶液中c(Fe3+)=c(Fe2+) D. 原溶液中c(Br-)=0.4mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com