
科目: 來源: 題型:
【題目】工業制硝酸的關鍵是氨的催化氧化,與硝酸工業相關的過程中產生的氮氧化物NOx(NO和NO2的混合物,假設不含N2O4)的處理與應用也是科學研究的熱點。
⑴工業上可用氨催化吸收法處理NOx,反應原理為4xNH3+6NOx![]() (2x+3)N2+6xH2O。某化學興趣小組模擬該處理過程的實驗裝置如圖所示:
(2x+3)N2+6xH2O。某化學興趣小組模擬該處理過程的實驗裝置如圖所示:
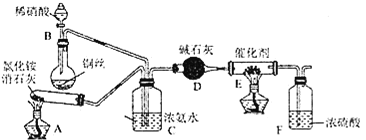
①裝置A中發生反應的化學方程式為________。
②裝置D中堿石灰的作用是________。
⑵工業上也常用Na2CO3溶液吸收法處理NOx(已知:NO不能與Na2CO3溶液反應)。NO+NO2+ Na2CO3 = 2 NaNO2+ CO2;
2NO2+ Na2CO3 = NaNO2+ NaNO3+ CO2。
①當NOx被Na2CO3溶液完全吸收時,x的值不可能是________![]() 填選項字母
填選項字母![]() 。
。
A.1.4 B.1.6 C.1.8
②將1 mol NOx通入Na2CO3溶液中,被完全吸收時,溶液中生成的NO3-、NO2-兩種離子的物質的量隨x變化關系如圖所示:
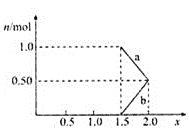
圖中線段a表示________![]() 填化學式
填化學式![]() 隨x值的變化關系;若用溶質質量分數為21.2%的Na2CO3溶液吸收,則需要Na2CO3溶液至少________g。
隨x值的變化關系;若用溶質質量分數為21.2%的Na2CO3溶液吸收,則需要Na2CO3溶液至少________g。
![]() 用足量的Na2CO3溶液完全吸收NOx,每產生22.4 L(標準狀況)CO2(全部逸出)時,吸收液質量就增加44g,則NOx中的
用足量的Na2CO3溶液完全吸收NOx,每產生22.4 L(標準狀況)CO2(全部逸出)時,吸收液質量就增加44g,則NOx中的![]() ________。
________。
⑶氨催化吸收法和Na2CO3溶液吸收法處理NOx尾氣的意義是________。
⑷尿素也可用于吸收處理NOx,其反應原理為NO+NO2+ H2O = 2HNO2、2HNO2+CO(NH2)2 = 3H2O + CO2↑+ 2N2↑。當混合氣體中NO、NO2按上述反應中系數比時吸收效果最佳。若混合氣體中V(NO):V(NO2)=5:1時,可通入一定量的空氣,同溫同壓下,V(空氣):V(NO)= ________ (空氣中O2的體積含量約為20%)。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列敘述正確的是
A.常溫下,將稀氨水逐滴加入稀硫酸中,當溶液的![]() 時,
時,![]()
B.兩種醋酸溶液的物質的量濃度分別為![]() 和
和![]() ,pH分別為a和
,pH分別為a和![]() ,則
,則![]()
C.常溫下,![]() 的NaOH溶液與
的NaOH溶液與![]() 的醋酸溶液等體積混合,滴入石蕊溶液呈紅色
的醋酸溶液等體積混合,滴入石蕊溶液呈紅色
D.向![]() 的氨水中加入少量硫酸銨固體,則溶液中
的氨水中加入少量硫酸銨固體,則溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目: 來源: 題型:
【題目】二甲胺是農藥螟鈴畏的重要中間體,在一定溫度壓強及催化劑條件下由氨與甲醇作用而制得,反應原理為:2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g)
已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
②2NH3(g)+![]() O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
③CH3NHCH3(g)+![]() O2(g)=2CO2(g)+
O2(g)=2CO2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH=-1872.6 kJ·mol-1
N2(g) ΔH=-1872.6 kJ·mol-1
(1)寫出CH3OH(g)與NH3(g)轉化為CH3NHCH3(g)和H2O(g)的熱化學方程式是____________。
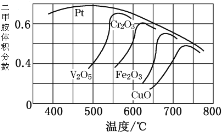
(2)不同的催化劑對二甲胺合成催化效率不同(如圖所示),則最合適的催化劑及溫度是_____________
(3)一定條件下,原料氣中n(CH3OH)/n(NH3)比值和溫度對NH3平衡轉化率影響的實驗數據如圖:
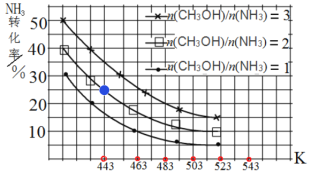
①溫度為443 K時,在1 L反應容器中投入4 mol NH3和8 mol CH3OH進行反應,試計算達到平衡時CH3NHCH3(g)濃度為_________molL-1,該溫度下化學平衡常數為_____________
②結合圖中數據,歸納 NH3平衡轉化率受外界條件影響的變化規律:a:_______b:________
(4)二甲胺水溶液類似于氨水,呈堿性;則二甲胺在水中的電離方程式為__________
(5)常溫下,將二甲胺和鹽酸等體積混合,兩種溶液的物質的量濃度和混合溶液的pH如表所示:
實驗編號 | 二甲胺濃度(mol.L-1) | 鹽酸濃度(mol.L-1) | 混合后溶液的PH |
甲 | 0.1 | 0.1 | a |
乙 | 0.15 | 0.1 | 8 |
丙 | 0.2 | 0.1 | 10 |
①實驗甲中,a______(填“大于”、“小于”或“等于”)7
②實驗丙混合后的溶液中離子濃度大小關系為______________
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖中的A、B、C、D、E、F、G均為有機物。
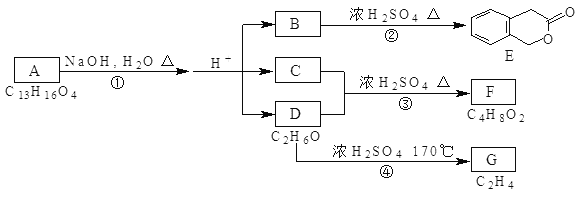
據上圖回答問題:
(1)D的名稱為:___;
(2)A的結構簡式是___;
(3)反應③的化學方程式是:___;
(4)符合下列3個條件的B的同分異構體的數目有___個;
I、含有二取代苯環結構 II、與B有相同官能團 III、不與FeCl3溶液發生顯色反應。寫出其中屬于鄰二取代苯環結構的任意一個同分異構體的結構簡式___;
(5)B不僅可以生成E,還可以在一定條件下形成高分子化合物,寫出B形成高分子化合物的化學方程式:___。
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖所示,燒杯內盛有濃硝酸,在燒杯內放入用導線連接的鐵、鉛兩個電極,已知原電池停止工作時,Fe、Pb均有剩余。下列說法正確的是( )
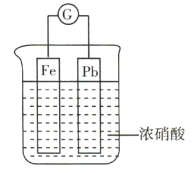
A.Fe比Pb活潑,故Fe始終作負極
B.Fe在濃硝酸中鈍化,故始終不溶解
C.原電池停止工作時,溶液中有![]()
D.利用濃硝酸作電解質溶液不符合“綠色化學”的思想
查看答案和解析>>
科目: 來源: 題型:
【題目】1 L某混合溶液中,溶質X、Y濃度都為0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物質的量如圖所示,則X、Y、Z分別是 ( )
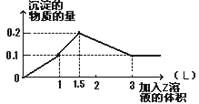
A.偏鋁酸鈉、氫氧化鋇、硫酸
B.氯化鋁、氯化鎂、氫氧化鈉
C.氯化鋁、氯化鐵、氫氧化鈉
D.偏鋁酸鈉、氯化鋇、硫酸
查看答案和解析>>
科目: 來源: 題型:
【題目】取等物質的量濃度的NaOH溶液兩份A和B,每份10 mL,分別向A、B中通入不等量的CO2,再繼續向兩溶液中逐滴加入0.1 mol/L的鹽酸,標準狀況下產生的CO2的體積與所加鹽酸體積之間的關系如下圖所示,試回答下列問題:
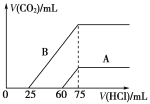
(1)原NaOH溶液的物質的量濃度為____________mol/L。
(2)曲線A表明,原NaOH溶液中通入CO2后,所得溶液中的溶質成分是____________,其物質的量之比為__________。
(3)曲線B表明,所得溶液加鹽酸后產生CO2氣體體積(標況)的最大值為 mL。
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖是某課外活動小組設計的用化學電源使LED燈發光的裝置。下列說法不正確的是( )

A.裝置中存在“化學能→電能→光能”的轉化
B.鋅片上發生的電極反應為![]()
C.如果將稀硫酸換成檸檬汁,則導線中不會有電子流動
D.如果將鋅片換成鐵片,則電路中的電流方向不變
查看答案和解析>>
科目: 來源: 題型:
【題目】25 ℃時,分別向20.00 mL 0.100 0 mol·L-1的氨水、醋酸銨溶液中滴加0.100 0 mol·L-1的鹽酸,溶液pH與加入鹽酸體積的變化關系如圖所示。下列說法錯誤的是( )
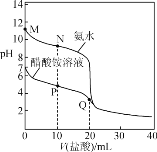
A.氨水的電離平衡常數的數量級約是10-5
B.N點:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P點:c(NH4+)<2c(CH3COO-)+c(NH3·H2O)
D.Q點:2c(Cl-)=c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目: 來源: 題型:
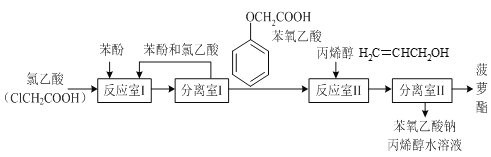
【題目】實驗室模擬工業生產食品香精菠蘿酯(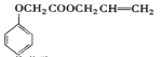 )的簡易流程如下:
)的簡易流程如下:
有關物質的熔、沸點如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔點/℃ | 43 | 62 | 99 |
沸點/℃ | 181.9 | 189 | 285 |
試回答下列問題:
(1)反應室I中反應的最佳溫度是104℃,為較好地控制溫度在102℃~106℃之間,加熱時可選用___(選填字母)。
A.火爐直接加熱 B.水浴加熱 C.油浴加熱
(2)分離室I采取的操作名稱是___。
(3)反應室I中發生反應的化學方程式是___。
(4)分離室II的操作為:①用NaHCO3溶液洗滌后分液;②有機層用水洗滌后分液;洗滌時不能用NaOH溶液代替NaHCO3溶液,其原因是___(用化學方程式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com