
【題目】二甲胺是農藥螟鈴畏的重要中間體,在一定溫度壓強及催化劑條件下由氨與甲醇作用而制得,反應原理為:2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g)
已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
②2NH3(g)+![]() O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
③CH3NHCH3(g)+![]() O2(g)=2CO2(g)+
O2(g)=2CO2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH=-1872.6 kJ·mol-1
N2(g) ΔH=-1872.6 kJ·mol-1
(1)寫出CH3OH(g)與NH3(g)轉化為CH3NHCH3(g)和H2O(g)的熱化學方程式是____________。
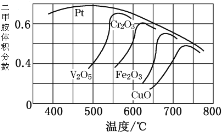
(2)不同的催化劑對二甲胺合成催化效率不同(如圖所示),則最合適的催化劑及溫度是_____________
(3)一定條件下,原料氣中n(CH3OH)/n(NH3)比值和溫度對NH3平衡轉化率影響的實驗數據如圖:
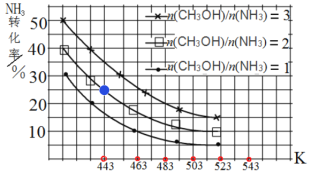
①溫度為443 K時,在1 L反應容器中投入4 mol NH3和8 mol CH3OH進行反應,試計算達到平衡時CH3NHCH3(g)濃度為_________molL-1,該溫度下化學平衡常數為_____________
②結合圖中數據,歸納 NH3平衡轉化率受外界條件影響的變化規律:a:_______b:________
(4)二甲胺水溶液類似于氨水,呈堿性;則二甲胺在水中的電離方程式為__________
(5)常溫下,將二甲胺和鹽酸等體積混合,兩種溶液的物質的量濃度和混合溶液的pH如表所示:
實驗編號 | 二甲胺濃度(mol.L-1) | 鹽酸濃度(mol.L-1) | 混合后溶液的PH |
甲 | 0.1 | 0.1 | a |
乙 | 0.15 | 0.1 | 8 |
丙 | 0.2 | 0.1 | 10 |
①實驗甲中,a______(填“大于”、“小于”或“等于”)7
②實驗丙混合后的溶液中離子濃度大小關系為______________
【答案】2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g) ΔH=-1367 kJ·mol-1 Pt、500℃ 1 ![]() a:其他條件不變,NH3平衡轉化率隨原料
a:其他條件不變,NH3平衡轉化率隨原料![]() 比值增大而增大 b:其他條件不變,NH3平衡轉化率隨反應溫度升高而減小 CH3NHCH3H2O(CH3)2NH2++OH- 小于 c[(CH3)2NH2+]>c(Cl-)>c(OH-)>c(H+)
比值增大而增大 b:其他條件不變,NH3平衡轉化率隨反應溫度升高而減小 CH3NHCH3H2O(CH3)2NH2++OH- 小于 c[(CH3)2NH2+]>c(Cl-)>c(OH-)>c(H+)
【解析】
(1)根據蓋斯定律,得到目標化學方程式。
(2)如圖可知催化效率最好的物質和溫度。
(3)①根據三段式建立關系進行計算;②根據圖像得出規律。
(4)仿照氨氣溶于水的電離方程式寫CH3NHCH3H2O的電離方程式。
(5)①二甲胺是一元弱堿;②實驗丙中反應后溶液中為等物質的量的CH3NHCH3H2O和(CH3)2NH2Cl,溶液呈堿性,CH3NHCH3H2O的電離程度大于(CH3)2NH2Cl的水解程度。
(1)根據蓋斯定律,目標化學方程式=①×2+②×![]() -③,熱化學方程式為2CH3OH(g)+NH3(g) CH3NHCH3(g)+2H2O(g) ΔH=-1367 kJ·mol-1,故答案為:2CH3OH(g)+NH3(g) CH3NHCH3(g) + 2H2O(g) ΔH=-1367 kJ·mol-1。
-③,熱化學方程式為2CH3OH(g)+NH3(g) CH3NHCH3(g)+2H2O(g) ΔH=-1367 kJ·mol-1,故答案為:2CH3OH(g)+NH3(g) CH3NHCH3(g) + 2H2O(g) ΔH=-1367 kJ·mol-1。
(2)如圖可知,Pt的催化效率最好且500℃達到最佳,故答案為:Pt、500℃。
(3)①443K時,NH3的轉化率為25%,三段式計算為
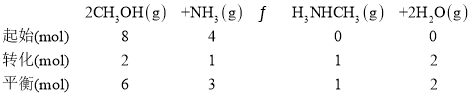 c(CH3NHCH3) =
c(CH3NHCH3) = ![]() =1mol·L-1,
=1mol·L-1,![]() ,故答案為:1;
,故答案為:1;![]() 。
。
②根據圖像得出規律為a:其他條件不變,NH3平衡轉化率隨原料![]() 比值增大而增大;b:其他條件不變,NH3平衡轉化率隨反應溫度升高而減小,故答案為:a:其他條件不變,NH3平衡轉化率隨原料
比值增大而增大;b:其他條件不變,NH3平衡轉化率隨反應溫度升高而減小,故答案為:a:其他條件不變,NH3平衡轉化率隨原料![]() 比值增大而增大;b:其他條件不變,NH3平衡轉化率隨反應溫度升高而減小。
比值增大而增大;b:其他條件不變,NH3平衡轉化率隨反應溫度升高而減小。
(4)仿照氨氣溶于水的電離方程式,CH3NHCH3H2O (CH3)2NH2++OH-,故答案為:CH3NHCH3H2O (CH3)2NH2++OH-。
(5)①二甲胺是一元弱堿,和鹽酸反應生成強酸弱堿鹽,則a < 7,故答案為:<。
②實驗丙中反應后溶液中為等物質的量的CH3NHCH3H2O和(CH3)2NH2Cl,溶液呈堿性;
CH3NHCH3H2O的電離程度大于(CH3)2NH2Cl的水解程度,離子濃度大小順序為:
c[(CH3)2NH2+]>c(Cl-)>c(OH-)>c(H+),故答案為:c[(CH3)2NH2+]>c(Cl-)>c(OH-)>c(H+)。


科目:高中化學 來源: 題型:
【題目】鋅在工業中有重要作用,也是人體必需的微量元素。回答下列問題:
(1)Zn原子價電子排布式為_________。
(2)ZnF2具有較高的熔點(872℃),ZnF2不溶于有機溶劑,而ZnI2能夠溶于乙醇、乙醚等有機溶劑,ZnI2晶體類型是__________。
(3)S和O為同主族元素,但兩者的簡單氫化物的熔沸點差異較大,其原因為:____。
(4)化合物Cl2O的立體構型為________,O原子的雜化方式為_____,可由Cl2與濕潤的Na2CO3反應可制備,其化學方程式為_______。
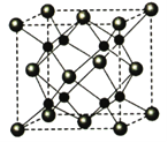
(5)Na和O能夠形成某種化合物,其晶胞結構與CaF2相似,如圖所示,晶胞參數邊長a cm,晶胞中O原子的配位數為_______;列式計算該晶體的密度(g·cm-3)_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,用0.100mol·L-1NaOH溶液分別滴定20.00mL0.100mol·L-1的鹽酸和醋酸,滴定曲線如圖所示,下列說法正確的是( )
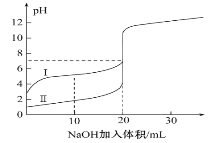
A.Ⅰ表示的是滴定鹽酸的曲線
B.醋酸的電離平衡常數K=1×10-5
C.pH>7時,滴定醋酸消耗V(NaOH)一定大于20mL
D.V(NaOH)=20mL時,兩份溶液中c(Cl-)=c(CH3COO-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用鋅片、銅片、發光二極管、濾紙、導線等在玻璃片制成如圖所示的原電池,當濾紙用醋酸溶液潤濕時,二極管發光.下列有關該電池的說法正確的是( )

A. 銅片上的電極反應:Cu — 2e﹣ = Cu2+
B. 鋅片為電池的負極
C. 外電路中電子由銅片經導線流向鋅片
D. 電池工作時電能直接轉化為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某課外活動小組設計的用化學電源使LED燈發光的裝置。下列說法不正確的是( )

A.裝置中存在“化學能→電能→光能”的轉化
B.鋅片上發生的電極反應為![]()
C.如果將稀硫酸換成檸檬汁,則導線中不會有電子流動
D.如果將鋅片換成鐵片,則電路中的電流方向不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列不符合節能減排要求的是( )
A.將煤塊粉碎提高燃料的燃燒效率
B.在汽車上安裝汽車尾氣催化轉化裝置,可使汽車尾氣中的![]() 和
和![]() 發生反應:
發生反應:![]()
C.在大力推廣乙醇汽油的同時,研究開發太陽能汽車和氫燃料電池汽車
D.在水力發電、火力發電、核能發電和風力發電中,要大力發展火力發電
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項敘述中,正確的是( )
A.Na、Mg、Al的未成對電子數依次增多
B.價電子排布為4s24p3的元素位于第四周期第ⅤA族,是p區元素
C.2p和3p軌道形狀均為啞鈴形,能量也相等
D.氮原子的最外層電子排布圖:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有些汽車安裝了安全氣囊,氣囊中裝有疊氮化鈉(![]() )等固體粉末。一旦汽車發生強烈的撞擊,疊氮化鈉將迅速分解生成鈉和氮氣(
)等固體粉末。一旦汽車發生強烈的撞擊,疊氮化鈉將迅速分解生成鈉和氮氣(![]() ),使安全氣囊打開,起到保護作用。此后氣體通過氣囊上的小孔迅速消散,氣囊收縮。
),使安全氣囊打開,起到保護作用。此后氣體通過氣囊上的小孔迅速消散,氣囊收縮。
(1)寫出疊氮化鈉發生分解反應的化學方程式:____________________。
(2)寫出安全氣囊中選用疊氮化鈉的理由:____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】298K時,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物質的量分數δ(X),δ(X)隨pH的變化如圖所示。下列敘述錯誤的是( )

A.Ka2(H3PO4)的數量級為10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7時c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液顯堿性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com