
科目: 來源: 題型:
【題目】碳及其化合物廣泛存在于自然界中,試回答下列問題:
(1)某處碳循環如圖所示,CaCO3轉化為HCO3-的離子方程式為_____________。

(2)常溫常壓下,空氣中的CO2溶于水,達到平衡時,無機碳在濃液中以4種形式存在,其轉化關系如下:
①CO2(g)+H2O![]() H2CO3 K=10-2.8
H2CO3 K=10-2.8
②H2CO3![]() H++HCO3- K1=10-3.5,
H++HCO3- K1=10-3.5,
③HCO3-![]() H++CO32- K2=10-10.3,
H++CO32- K2=10-10.3,
若溶液中。c(CO2)=1.0×10-5mol/L,且忽略水的電離及H2CO3的第二級電離,則溶液pH=_____。
(3)某化學小組為了測量湖水中無機碳的含量,量取 100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,將吸收液用0.10mol/L鹽酸滴定,生成的V(CO2)隨V (鹽酸)變化關系如圖2所示,則吸收液中離子濃度由大到小的順序為______________(不用寫出H+),湖水中無機碳的濃度為_______mol/L。

(4)—定條件下,CO2和H2O可以轉化為CO和H2,通過反應:CO(g)+2H2(g) ![]() CH3OH(g)制備甲醇,若起始時在密閉容器中按物質的量之比1:2充入CO和H2,測得平衡時CO轉化率a (CO)隨T、P的變化關系如圖3所示。
CH3OH(g)制備甲醇,若起始時在密閉容器中按物質的量之比1:2充入CO和H2,測得平衡時CO轉化率a (CO)隨T、P的變化關系如圖3所示。

①P1__P2(填“大于”、“小于”或“等于”);
②該反應在195℃、P2條件下達到平衡后,c(H2)=0.5 mol/L ,則該反應的平衡常數為______。
③已知CH3OH和CO的燃燒熱分別725.8kJ/mol、283.0 kJ/mol,1mol液態水變成氣態水吸熱44.0kJ,寫出甲醇不完全燃燒生成一氧化碳和氣態水的熱化學方程式:_________________。
(5)用CH3OH和O2組合形成的質子交換膜燃料電池的結構示意圖4,則c電極的反應方程式為:_______________ 。

查看答案和解析>>
科目: 來源: 題型:
【題目】下列反應的產物中,有的有同分異構體,有的沒有同分異構體,其中一定不存在同分異構體的反應是
A.異戊二烯(![]() )與等物質的量的Br2發生加成反應
)與等物質的量的Br2發生加成反應
B.2氯丁烷與NaOH乙醇溶液共熱發生消去HCl分子的反應
C.甲苯在一定條件下發生硝化反應生成一硝基甲苯的反應
D.鄰羥基苯甲酸與NaHCO3溶液反應
查看答案和解析>>
科目: 來源: 題型:
【題目】用NA表示阿伏加德羅常數,下列敘述中正確的是
A. 0.1 molKI與0.1 molFeC13在溶液中反應轉移的電子數為0.1NA
B. 鎂條在氮氣中完全燃燒,生成50g氮化鎂時,有1.5NA共用電子對被破壞
C. 3.0g由葡萄糖和冰醋酸組成的混合物中含有的原子總數為0.3NA
D. 標況時,22.4L二氯甲烷所含有的分子數為NA
查看答案和解析>>
科目: 來源: 題型:
【題目】有關![]() 的說法正確的是
的說法正確的是
A.所有碳原子不可能都在同一平面上
B.最多只可能有9個碳原子在同一平面上
C.有7個碳原子可能在同一直線上
D.只可能有5個碳原子在同一直線上
查看答案和解析>>
科目: 來源: 題型:
【題目】下列敘述中正確的是![]()
A.檢驗稀鹽酸和氫氧化鈉溶液是否恰好完全反應,可在反應后溶液中滴加無色酚酞溶液,無明顯現象,恰好完全反應
B.某液體可能是海水或蒸餾水,將其蒸發結晶,液體消失,無殘留物,該液體為蒸餾水
C.某溶液完全蒸發后無固體殘留物,該溶液中一定含硫酸根離子
D.某溶液中加入稀鹽酸有氣泡產生,該溶液中一定含碳酸根離子
查看答案和解析>>
科目: 來源: 題型:
【題目】有機物M是有機合成的重要中間體,制備M的一種合成路線如下(部分反應條件和試劑已略去)
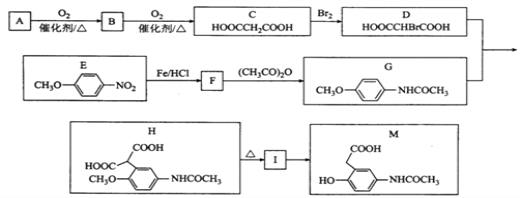
已知: ①A的密度是相同條件下H2密度的38倍;其分子的核磁共振氫譜中有3組峰;
②![]()
③![]()
請回答下列問題:
(1)B的化學名稱為______________。A中官能團的電子式為________________。
(2)C中共面的原子最多有________個。I的結構簡式為_____________________。
(3)F→G的化學方程式為________________________________________________。
(4)M不可能發生的反應為_______________(填選項字母)
A.加成反應 B.氧化反應 C.取代反應 D.消去反應
(5)同時滿足下列條件的E的同分異構體有_________種。
①能與FeCl3溶液發生顯色反應 ②能與NaHCO3反應 ③含有—個—NH2
(6)參照上述合成路線,以 ![]() 為原料(無機試劑任選),設計制備
為原料(無機試劑任選),設計制備![]() 的合成路線:_______________________________________________。
的合成路線:_______________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】鋰-銅空氣燃料電池容量高、成本低,具有廣闊的發展前景。該電池通過一種復雜的銅腐蝕“現象”產生電力,其中放電過程為2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列說法不正確的是( )

A.放電時,正極的電極反應式為O2+2H2O+4e-=4OH-
B.放電時,Li+透過固體電解質向Cu極移動
C.通空氣時,銅被腐蝕,表面產生Cu2O
D.整個反應過程中,氧化劑為O2
查看答案和解析>>
科目: 來源: 題型:
【題目】硫酸是重要的化工原料,工業制取硫酸最重要的一步反應為:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)為提高SO2的轉化率,可通入過量O2,用平衡移動原理解釋其原因:___________。
(2)某興趣小組在實驗室對該反應進行研究,部分實驗數據和圖像如下。
反應條件:催化劑、一定溫度、容積10 L
實驗 | 起始物質的量/mol | 平衡時SO3 物質的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
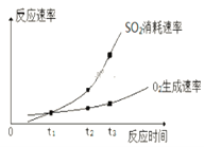
①實驗ⅰ中SO2的轉化率為______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,達到化學平衡狀態的是________。
④ t2到t3的變化是因為改變了一個反應條件,該條件可能是___________。
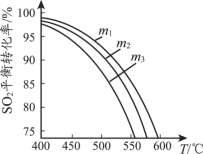
(3)將SO2和O2充入恒壓密閉容器中,原料氣中SO2 和O2的物質的量之比m(m=n(SO2)/n(O2))不同時,SO2的平衡轉化率與溫度(T)的關系如下圖所示,則m1、m2、m3的大小順序為_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室利用二氧化錳和濃鹽酸反應制取Cl2,化學方程式如下:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)請用單線橋標出該反應電子轉移的方向和數目__,該反應的氧化產物是__。
(2)其中氧化劑與還原劑的物質的量之比是__;若實驗中有87g的MnO2完全反應,則制得的Cl2在標況下的體積是__L。
查看答案和解析>>
科目: 來源: 題型:
【題目】“人文奧運”的一個重要體現是:堅決反對運動員服用興奮劑。某種興奮劑的結構簡式如圖所示,有關該物質的說法正確的是()
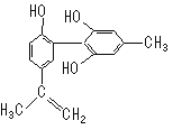
A.遇FeCl3溶液顯紫色,因為該物質與苯酚屬于同系物
B.滴入KMnO4(H+)溶液,觀察紫色褪去,能證明結構中存在碳碳雙鍵
C.1 mol該物質與濃溴水和H2反應最多消耗Br2和H2分別為3mol、7 mol
D.該分子中的所有碳原子可能共平面
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com