
科目: 來源: 題型:
【題目】室溫下,用![]() 的
的![]() 溶液滴定
溶液滴定![]()
![]() 的
的![]() 溶液,水的電離程度隨
溶液,水的電離程度隨![]() 溶液體積的變化曲線如圖所示。下列說法正確的是( )
溶液體積的變化曲線如圖所示。下列說法正確的是( )

A.該滴定過程應該選擇甲基橙作為指示劑
B.從![]() 點到
點到![]() 點,溶液中水的電離程度逐漸增大
點,溶液中水的電離程度逐漸增大
C.![]() 點溶液中
點溶液中![]()
D.![]() 點對應的
點對應的![]() 溶液的體積為
溶液的體積為![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】在一定溫度下,將氣體X和氣體Y各![]() 充入10L恒容密閉容器中,發生反應
充入10L恒容密閉容器中,發生反應![]() ,一段時間后達到平衡,反應過程中測定的數據如下表:下列說法正確的是
,一段時間后達到平衡,反應過程中測定的數據如下表:下列說法正確的是![]()
| 2 | 4 | 7 | 9 |
|
|
|
|
|
A.8min時,其他條件不變,若增大X的濃度,則反應速率加快,活化分子百分數增加
B.該溫度下此反應的平衡常數![]()
C.其他條件不變,降低溫度,反應達到新平衡前![]() 逆
逆![]() 正
正![]()
D.其他條件不變,再充入![]() ,平衡時X的體積分數增大
,平衡時X的體積分數增大
查看答案和解析>>
科目: 來源: 題型:
【題目】以![]() 和
和![]() 為原料,通過反應:
為原料,通過反應:![]() 合成尿素。該反應的平衡常數和溫度關系如下表;在一定溫度和壓強下,若原料氣中的
合成尿素。該反應的平衡常數和溫度關系如下表;在一定溫度和壓強下,若原料氣中的![]() 和
和![]() 物質的量之比
物質的量之比![]() 氨碳比
氨碳比![]() 與
與![]() 平衡轉化率
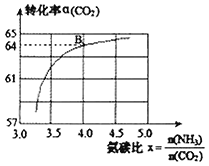
平衡轉化率![]() 的關系如圖,下列說法正確的是
的關系如圖,下列說法正確的是
| 165 | 175 | 185 | 195 |
K |
|
|
|
|
A.如圖點B處![]() 的平衡轉化率為
的平衡轉化率為![]()
B.該反應平衡常數的表達式為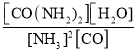
C.該反應中反應物的總鍵能大于生成物的總鍵能
D.氨碳比越高,合成![]() 時
時![]() 的轉化率越高
的轉化率越高
查看答案和解析>>
科目: 來源: 題型:
【題目】久置的FeSO4溶液變黃,一般認為是二價鐵被氧化為三價鐵的緣故。某硏究小組為硏究溶液中Fe2+被O2氧化的過程,查閱資料發現:溶液中Fe2+的氧化過程分為先后兩步,首先是Fe2+水解,接著水解產物被O2氧化。于是小組同學決定研究常溫下不同pH對Fe2+被O2氧化的影響,并測定了Fe2+氧化率隨時間變化的關系,結果如圖。
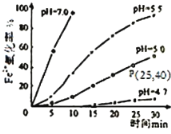
回答下列問題:
(1)寫出Fe2+水解的離子方程式___;要抑制FeSO4水解,可以采取的措施是___。
(2)若配制的FeSO4溶液濃度為0.01mol/L,反應過程中溶液體積不變,計算圖中P點Fe2+的氧化速率___。
(3)在酸性條件下,Fe2+被O2氧化的反應方程式為:4Fe2++O2+4H+![]() 4Fe3++2H2O,已知常溫下該反應的平衡常數很大。則下列說法正確的是___。
4Fe3++2H2O,已知常溫下該反應的平衡常數很大。則下列說法正確的是___。
a.Fe2+轉化為Fe3+的趨勢很大
b.Fe2+轉化為Fe3+的速率很大
c.該反應進行得很完全
d.酸性條件下Fe2+不會被氧化
(4)結合圖分析不同pH對Fe2+被O2氧化的反應產生了怎樣的影響___。
(5)用K2Cr2O7標準溶液測定溶液中Fe2+濃度,從而計算Fe2+的氧化率。反應如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待測溶液,用0.0200mol·L1K2Cr2O7標準溶液滴定,消耗標準溶液16.50mL,則溶液中c(Fe2+)=___mol·L1。
查看答案和解析>>
科目: 來源: 題型:
【題目】短周期原子序數依次遞增的 A、B、C、D、E、F 六種元素,已知B 原子最外層電子數是A 原子次外層電子數的 3 倍,是 D 原子最外層電子數的 2 倍;C 原子內層電子總數是最外層電子數 10 倍;A、B、D 三種元素的原子最外層電子數之和為 13; A 和B 原子最外層電子數之和與D 和 F 原子最外層電子數之和相等; E 和 F 是相鄰元素。回答下列問題:
(1)E 元素的名稱為__;其在元素周期表中的位置是__。
(2)AB2 的電子式為__;用電子式表示E 的氫化物的形成過程__。
(3)C 和 F 元素的最高價氧化物的水化物反應的化學方程式為__;
(4)B、C、D、F 四種元素原子半徑由大到小的順序是__(填元素符號),離子半徑最小的是__(填離子符號)。
(5)B 和 E 的簡單氫化物中沸點較高的是__(填化學式),A 和B 的簡單氫化物中穩定性較好的是__(填化學式)。
(6)短周期元素M 與 D 元素位于不同主族,根據對角線規則二者某些性質相似。將 M 的最高價氧化物溶于 C 的最高價氧化物對應的水化物溶液中,發生反應的離子方程式為__。
(7)由 B、C 兩種元素組成的化合物有兩種,其中一種為淡黃色,該物質的電子式為__。
查看答案和解析>>
科目: 來源: 題型:
【題目】碳酸二甲酯(CH3OCOOCH3,簡稱DMC)是一種應用前景廣泛的新材料。在密閉容器中按n(CH3OH):n(CO2)=2:1投料直接合成DMC,反應方程式為:2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)。一定條件下,平衡時CO2的轉化率如圖所示。下列說法中不正確的是( )
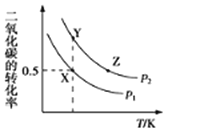
A.該反應的正反應為放熱反應
B.壓強![]()
C.X點對應的平衡常數為![]()
D.X、Y、Z三點對應的初始反應速率的關系為Z>Y>X
查看答案和解析>>
科目: 來源: 題型:
【題目】已知NA是阿伏加德羅常數的值,下列說法錯誤的是( )
A.48 g正丁烷和10 g異丁烷的混合物中共價鍵數目為13NA
B.78g ![]() 中含有雙鍵數為3NA
中含有雙鍵數為3NA
C.17g![]() 中含有的電子數為9NA
中含有的電子數為9NA
D.常溫常壓下,1 L甲醛氣體所含的分子數小于NA
查看答案和解析>>
科目: 來源: 題型:
【題目】某實驗小組研究溫度對化學反應![]() 的影響,在其他條件相同時,將
的影響,在其他條件相同時,將![]() 和
和![]() 充入體積為2L的恒容密閉容器中,測得
充入體積為2L的恒容密閉容器中,測得![]() 的物質的量分數隨時間
的物質的量分數隨時間![]() 變化的實驗數據如下:
變化的實驗數據如下:
時間 | 0 | 20 | 40 | 60 | 80 | 100 | |
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
| |
下列說法正確的是 ![]()
![]()
A. ![]() 溫度下,
溫度下,![]() 之間,
之間,![]() 的平均反應速率為
的平均反應速率為![]()
B. 在![]() 溫度下,該反應有可能在70min時已達到平衡狀態
溫度下,該反應有可能在70min時已達到平衡狀態
C. 由表中數據推測,![]()
D. 由表中數據可知,溫度越高,![]() 與
與![]() 的反應限度越大
的反應限度越大
查看答案和解析>>
科目: 來源: 題型:
【題目】在某溫度下,向三個初始體積為1L的密閉容器中按表所示投料,發生反應N2(g)+3H2(g)2NH3(g)△H<0,達到平衡時,下列說法錯誤的是
容器編號 | 容器類型 | 起始物質的量 | 反應物的轉化率 | 平時時 | ||
|
|
| ||||
Ⅰ | 恒溫恒容 | 1 | 3 | 0 |
|
|
Ⅱ | 絕熱恒容 | 0 | 0 | 2 |
| a |
Ⅱ | 恒溫恒壓 | 1 | 3 | 0 |
| b |
A.平衡時NH3的物質的量:a>1.2,b>1.2
B.容器I、II中平衡常數關系:K(I)>K(II)
C.a1+a2<1
D.若起始時向容器A中充入lmolN2(g)、0.4molH2(g)、0.4molNH3(g),此時平衡向正反應方向移動
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,下列各組離子在指定溶液中一定能大量共存的是( )
A.能使甲基橙變紅的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、Al3+、SO42-、Cl-
C.無色透明的溶液中:Fe3+、Al3+、NO3-、SO42-
D.常溫下,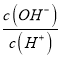 =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com