
科目: 來源: 題型:
【題目】25℃時,pH=2的鹽酸和醋酸各1mL分別加水稀釋,pH隨溶液體積變化的曲線如下圖所示。下列說法不正確的是( )

A. 曲線Ⅰ代表鹽酸的稀釋過程 B. a溶液的導電性比c溶液的導電性強
C. a溶液中和氫氧化鈉的能力強于b溶液 D. 將a、b兩溶液加熱至30℃, 變小
變小
查看答案和解析>>
科目: 來源: 題型:
【題目】![]() 時,向
時,向![]() 溶液中滴加等濃度的NaOH溶液,溶液的pH與NaOH溶液的體積關系如圖所示.下列敘述不正確的是
溶液中滴加等濃度的NaOH溶液,溶液的pH與NaOH溶液的體積關系如圖所示.下列敘述不正確的是![]()

A.C點溶液中含有![]() 和
和![]()
B.![]() 溶液中水的電離程度比
溶液中水的電離程度比![]() 溶液中小
溶液中小
C.B點,![]()
D.D點,![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】下列熱化學方程式中,正確的是( )
A. 甲烷的燃燒熱為 890.3 kJ/mol,則甲烷燃燒的熱化學方程式可表示為: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,將 0.5mol N2和 1.5molH2置于密閉容器中充分反應生成 NH3(g),放熱 19.3 kJ,其熱化學方程式為:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀鹽酸和 稀氫氧化鈉溶液混合, 其熱化學方程式為:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃燒放熱 142.9kJ,則氫氣燃燒的熱化學方程式為: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
查看答案和解析>>
科目: 來源: 題型:
【題目】在標準狀況下,在三個干燥的燒瓶內分別裝有純凈的NH3,含一半空氣的HCl氣體, NO2 和O2的混合氣體[V(NO2)∶V(O2) = 4∶1 ],然后分別作噴泉實驗,三個燒瓶內所得溶液的物質的量濃度之比為
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 無法確定
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下,分別取濃度不同、體積均為20.00mL的3種HCl溶液,分別滴入濃度為1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,測得3個反應體系的pH隨V(NaOH)的變化的曲線如圖,在V(NaOH)=20.00mL前后出現突躍。下列說法不正確的是
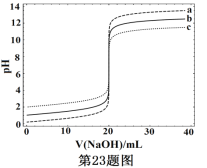
A. 3種HCl溶液的c(HCl):最大的是最小的100倍
B. 曲線a、b、c對應的c(NaOH):a>b>c
C. 當V(NaOH)=20.00mL時,3個體系中均滿足:c(Na+)=c(Cl-)
D. 當V(NaOH)相同時,pH突躍最大的體系中的c(H+)最大
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,用0.10mol/L的氨水滴定10.0mLamol/L的鹽酸,溶液的pH與氨水體積(V)的關系如圖所示

已知:N點溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列說法不正確的是( )
A.a=0.10
B.N、P兩點溶液中水的電離程度:N<P
C.M、N兩點溶液中NH4+的物質的量之比大于1:2
D.Q點溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目: 來源: 題型:
【題目】含氮化合物在工農業生產中都有重要應用。
(1)氮和肼(N2H4)是兩種最常見的氮氫化物。
已知:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化學平衡常數為K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化學平衡常數為K1。N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化學平衡常數為K2。則用NH3和O2制取N2H4的熱化學方程式為__________________,該反應的化學平衡常數K=________(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化學平衡常數為K2。則用NH3和O2制取N2H4的熱化學方程式為__________________,該反應的化學平衡常數K=________(用K1、K2表示)。
(2)對于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定溫度下,于1 L的恒容密閉容器中充入0.1 mol NO和0.3 mol CO,反應開始進行。
N2(g)+2CO2(g),在一定溫度下,于1 L的恒容密閉容器中充入0.1 mol NO和0.3 mol CO,反應開始進行。
①下列能說明該反應已經達到平衡狀態的是______(填字母代號)。
A.c(CO)=c(CO2)
B.容器中混合氣體的密度不變
C.v(N2)正=2v(NO)逆
D.容器中混合氣體的平均摩爾質量不變
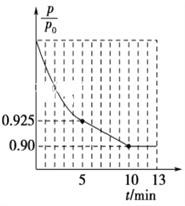
②圖1為容器內的壓強(p)與起始壓強(p0)的比值![]() 隨時間(t)的變化曲線。0~5min內,該反應的平均反應速率v(N2)=________,平衡時NO的轉化率為________。
隨時間(t)的變化曲線。0~5min內,該反應的平均反應速率v(N2)=________,平衡時NO的轉化率為________。
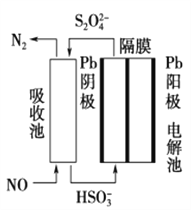
(3)使用間接電化學法可處理燃燒煙氣中的NO,裝置如圖所示。已知電解池的陰極室中溶液的pH在4~7之間,寫出陰極的電極反應式:____________________。用離子方程式表示吸收池中除去NO的原理____________________________________________。
【答案】 4NH3(g)+O2(g)2N2H4(g)+2H2O(g)ΔH=+526.2 kJ·mol-1 K1/K22 D 0.006 mol·L-1·min-1 80% 2HSO3-+2e-+2H+===S2O42-+2H2O 2NO+2S2O42-+2H2O===N2+4HSO3-
【解析】(1)①4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化學平衡常數為K1。②N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化學平衡常數為K1。②N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化學平衡常數為K2。根據蓋斯定律,將①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,該反應的化學平衡常數K=
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化學平衡常數為K2。根據蓋斯定律,將①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,該反應的化學平衡常數K=![]() ,故答案為:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol;
,故答案為:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol; ![]() ;
;
(2)對于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定溫度下,于1L的恒容密閉容器中充入0.1molNO和0.3molCO,反應開始進行。
N2(g)+2CO2(g),在一定溫度下,于1L的恒容密閉容器中充入0.1molNO和0.3molCO,反應開始進行。
①A.c(CO)=c(CO2),不表示濃度變化,不能判斷是否為平衡狀態,故A錯誤;B.反應中氣體的質量不變,體積不變,容器中混合氣體的密度始終不變,不能判斷是否為平衡狀態,故B錯誤;C.v(N2)正=2v(NO)逆表示,應該是2v(N2)正=v(NO)逆,才表示正逆反應速率相等,故C錯誤;D.該反應屬于氣體的物質的量發生變化的反應,容器中混合氣體的平均摩爾質量不變時表示氣體的物質的量不變, 說明是平衡狀態,故D正確;故選D;
②根據容器內的壓強(P)與起始壓強(P0)的比值(P/P0)隨時間(t)的變化曲線,0~5min內,![]() =0.925,根據阿伏伽德羅定律及其推論,
=0.925,根據阿伏伽德羅定律及其推論,![]() =0.925,平衡時
=0.925,平衡時![]() =0.90,
=0.90,
2NO(g)+ 2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol) 0.1 0.3 0 0
反應 2x 2x x 2x
5min及平衡 0.1-2x 0.3-2x x 2x
5min時,![]() =0.925,解得x=0.03mol,v(N2)=
=0.925,解得x=0.03mol,v(N2)=![]() = 0.006mol·L-1·min-1;平衡時,
= 0.006mol·L-1·min-1;平衡時,![]() =0.90,解得x=0.04mol,NO的轉化率=
=0.90,解得x=0.04mol,NO的轉化率=![]() ×100%=80%,故答案為:0.006 mol·L-1·min-1;80%;
×100%=80%,故答案為:0.006 mol·L-1·min-1;80%;
(3)陰極發生還原反應,是亞硫酸氫根離子,得電子,生成硫代硫酸根離子,電極反應式為:2HSO3-+2e-+2H+═S2O42-+2H2O;硫代硫酸根離子與一氧化氮發生氧化還原反應,生成氮氣,離子反應方程式為:2NO+2S2O42-+2H2O═N2+4HSO3-;故答案為:2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-。
【題型】填空題
【結束】
10
【題目】鋰離子電池是目前具有最高比能量的二次電池。LiFePO4可極大地改善電池體系的安全性能,且具有資源豐富、循環壽命長、環境友好等特點,是鋰離子電池正極材料的理想選擇。生產LiFePO4的一種工藝流程如圖:
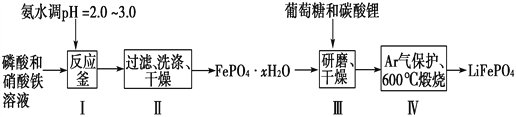
已知:Ksp(FePO4·xH2O)=1.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。
(1)在合成磷酸鐵時,步驟Ⅰ中pH的控制是關鍵。如果pH<1.9,Fe3+沉淀不完全,影響產量;如果pH>3.0,則可能存在的問題是________________。
(2)步驟Ⅱ中,洗滌是為了除去FePO4·xH2O表面附著的________等離子。
(3)取3組FePO4·xH2O樣品,經過高溫充分煅燒測其結晶水含量,實驗數據如下表:
實驗序號 | 1 | 2 | 3 |
固體失重質量分數 | 19.9% | 20.1% | 20.0% |
固體失重質量分數=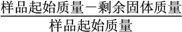 ×100%,則x=_______(精確至0.1)。
×100%,則x=_______(精確至0.1)。
(4)步驟Ⅲ中研磨的作用是__________________________________。
(5)在步驟Ⅳ中生成了LiFePO4、CO2和H2O,則氧化劑與還原劑的物質的量之比為________。
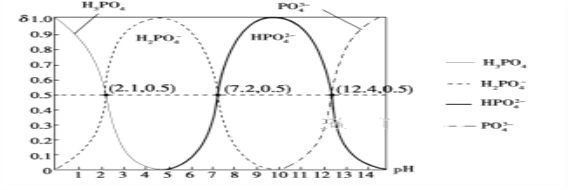
(6)H3PO4是三元酸,如圖是常溫下溶液中含磷微粒的物質的量分數(δ)隨pH變化示意圖。則PO![]() 第一步水解的水解常數K1的表達式為______,K1的數值最接近______(填字母)。
第一步水解的水解常數K1的表達式為______,K1的數值最接近______(填字母)。
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2
查看答案和解析>>
科目: 來源: 題型:
【題目】按要求寫出下列物質的結構簡式:
(1)2,4-二氯甲苯的結構簡式為____;
(2)反-2-戊烯的結構簡式為___;
(3)分子式為C6H12的某烯烴與氫氣加成后得到的烷烴分子中含4個甲基,且該烯烴不存在順反異構體,則該烯烴的一種結構簡式為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】T℃,分別向10 mL濃度均為1![]() 的兩種弱酸HA,HB中不斷加水稀釋,并用pH傳感器測定溶液
的兩種弱酸HA,HB中不斷加水稀釋,并用pH傳感器測定溶液![]() 。所得溶液pH的兩倍(2pH)與溶液濃度的對數(lgc)的關系如圖所示。已知:pKa=-lgKa,下列敘述正確的是( )
。所得溶液pH的兩倍(2pH)與溶液濃度的對數(lgc)的關系如圖所示。已知:pKa=-lgKa,下列敘述正確的是( )
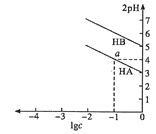
A.弱酸的Ka隨溶液濃度的降低而增大
B.a點對應的溶液中c(HA)=0.1mol/L,pH=4
C.弱酸![]() 的pK≈5
的pK≈5
D.酸性: HA<HB
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室用H2還原WO3制備金屬W的裝置如圖所示(Zn粒中往往含有硫等雜質,焦性沒食子酸溶液用于吸收少量氧氣),下列說法正確的是
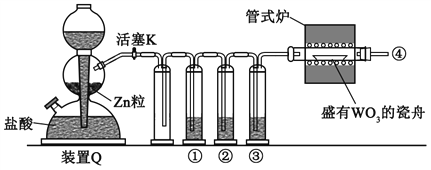
A. ①、②、③中依次盛裝KMnO4溶液、濃H2SO4、焦性沒食子酸溶液
B. 管式爐加熱前,用試管在④處收集氣體并點燃,通過聲音判斷氣體純度
C. 結束反應時,先關閉活塞K,再停止加熱
D. 裝置Q(啟普發生器)也可用于二氧化錳與濃鹽酸反應制備氯氣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com