
科目: 來源: 題型:
【題目】將10 g Fe2O3、SiO2、Al2O3的混合物加入足量的100 mL x mol/L稀硫酸中,過濾,然后加入10 mol/L NaOH溶液,產生沉淀的質量和加入NaOH溶液的體積關系如圖所示。下列敘述錯誤的是
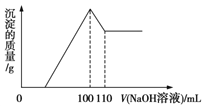
A.濾出的物質為SiO2
B.可求出x的值
C.可求出Al2O3的質量分數
D.可求出Fe2O3的質量分數
查看答案和解析>>
科目: 來源: 題型:
【題目】下列反應中,氧化劑與還原劑為同一種物質的是
A.SO2+2H2S=3S↓+H2B.2NO2+2NaOH=NaNO2+NaNO3+H2O
C.Zn+2HCl=ZnCl2+H2↑D.MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】已知X是某金屬單質,X、A、B、C含同一種元素,可發生如下轉化:
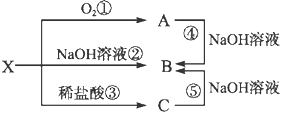
(1)寫出以下反應的離子方程式:
②___________________________;
④___________________________。
(2)確定化學式B_______ X_______
查看答案和解析>>
科目: 來源: 題型:
【題目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定溫度下,在體積恒定的密閉容器中,加入1 mol X(g) 與2mol Y (g),下列說法正確的是( )
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定溫度下,在體積恒定的密閉容器中,加入1 mol X(g) 與2mol Y (g),下列說法正確的是( )
A.充分反應后,X的轉化率和Y的轉化率不相等,前者大于后者
B.當反應達到平衡狀態時,W與M的物質的量濃度之比一定為2:1
C.當混合氣體的密度不再改變,表明該反應已達平衡
D.若增大Y的濃度,正反應速率增大,逆反應速率減小
查看答案和解析>>
科目: 來源: 題型:
【題目】在日常生活和生產過程中化學有著重要的應用,下列有關說法正確的是
A.洪澇、地震災區災后可用石灰消毒,是利用石灰可使蛋白質發生變性的性質
B.食品添加劑對人體均有益,可隨意使用
C.生活中常見的石英玻璃、普通玻璃、鋼化玻璃都屬于硅酸鹽產品
D.![]() 是指大氣中直徑小于或等于
是指大氣中直徑小于或等于![]() 微米的顆粒物,也稱為可入肺顆粒物,分散在空氣中可能形成膠體
微米的顆粒物,也稱為可入肺顆粒物,分散在空氣中可能形成膠體
查看答案和解析>>
科目: 來源: 題型:
【題目】下列工業生產所涉及的化學用語表達不正確是
A.工業上制取氯氣:MnO2+4HCl![]() Cl2↑+MnCl2+H2O
Cl2↑+MnCl2+H2O
B.工業上合成氨:N2+3H2![]() 2NH3
2NH3
C.工業上制取粗硅:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.工業上生產漂白粉:![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】某學生用0.10mol/L的標準NaOH溶液滴定未知濃度的鹽酸,其操作如下:
①用蒸餾水洗滌堿式滴定管,并立即注入NaOH溶液至“0”刻度線以上;
②固定好滴定管并使滴定管尖嘴處充滿液體;
③調節液面至“0”或“0”刻度線稍下,并記下讀數;
④移取20.00mL待測液注入潔凈的錐形瓶中,并加入3滴酚酞溶液;
⑤用標準液滴定至終點,記下滴定管液面讀數。
請回答:
(1)以上步驟有錯誤的是(填編號)___。
(2)判斷滴定終點的現象是___。
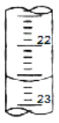
(3)如圖是某次滴定時滴定管中的液面,其讀數為__mL。
(4)根據下列數據:請計算待測鹽酸溶液的物質的量濃度c(HCl)=___mol/L。
滴定次數 | 待測體積(mL) | 標準燒堿體積(mL) | |
滴定前讀數 | 滴定后讀數 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)若測定結果偏高,其原因可能是___。
A.在配制0.10mol/LNaOH標準溶液定容時,俯視容量瓶刻度線
B.盛裝未知液的錐形瓶用蒸餾水洗過后再用未知液潤洗
C.滴定終點讀數時,仰視滴定管的刻度
D.步驟⑤中,在記下滴定管液面讀數時,滴定管尖嘴有氣泡
(6)某同學用0.10mol/LNaOH標準溶液分別滴定20.00mL0.10mol/L的HCl溶液和20.00mL0.10mol/L的CH3COOH溶液,得到如圖所示的兩條滴定曲線:
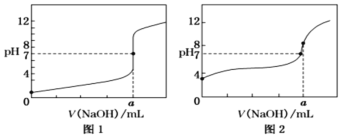
①用0.10mol/L的NaOH標準溶液滴定20.00mL0.10mol/L的CH3COOH溶液的曲線是___(填“圖1”或“圖2”)。
②a=___mL。
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,三種酸的電離平衡常數如下:
化學式 | CH3COOH | H2CO3 | HClO |
電離平衡常數 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列問題:
(1)一般情況下,當溫度升高時,Ka___(填“增大”、“減小”或“不變”)。
(2)下列四種離子結合質子能力由大到小的順序是___(填序號)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸餾水稀釋0.1mol/L的醋酸,下列各式表示的數值隨水量的增加而增大的是___(填序號)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常溫下,0.1mol/LNaHCO3溶液的pH大于8,則溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃時,若測得CH3COOH與CH3COONa的混合溶液的pH=6,則溶液中:
①![]() =___(填“精確數值”,下同)。
=___(填“精確數值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列化學反應中,不屬于離子反應的是( )
A.在水溶液中:CH3COOH+NH3·H2O===CH3COONH4+H2O
B.在水溶液中:Cu(OH)2+2HNO3===Cu(NO3)2+2H2O
C.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D.在水溶液中:CaSO4+Na2CO3===CaCO3↓+Na2SO4
查看答案和解析>>
科目: 來源: 題型:
【題目】高溫下用H2還原CuCl制備活性銅,反應原理如下:
2Cu(s)+Cl2(g) ![]() 2CuCl(s) ΔH1=-36 kJ·mol-1①
2CuCl(s) ΔH1=-36 kJ·mol-1①
H2(g)+2CuCl(s) ![]() 2Cu(s)+2HCl(g) ΔH2②
2Cu(s)+2HCl(g) ΔH2②
有關物質的鍵能數據如下表:
物質 | H2 | Cl2 | HCl |
鍵能/kJ·mol-1 | 436 | 243 | 432 |
(1)ΔH2=________kJ·mol-1。
(2)經測定反應②制備活性銅的反應趨勢大,原因是__________。
(3)在某溫度下,反應①達到平衡狀態,在tl時,增加壓強到原來的2倍(Cu的量足夠),在圖中畫出Cl2濃度的變化趨勢線。________________________

(4)白色不溶于水的CuCl可以由電解法制得,如圖所示:

①裝置中用的交換膜為________。
A.陽離子交換膜 B.陰離子交換膜
C.質子交換膜 D.氫氧根離子交換膜
②陽極的電極反應式為______________________________________________。
(5)已知CuCl可溶解于稀硝酸,寫出該反應的化學方程式:
________________________________________________________________________。
(6)根據已學知識寫出制取CuCl的一種方法,用化學方程式表示:____________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com