
【題目】已知X是某金屬單質,X、A、B、C含同一種元素,可發生如下轉化:
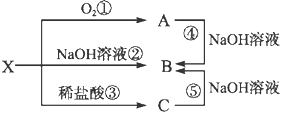
(1)寫出以下反應的離子方程式:
②___________________________;
④___________________________。
(2)確定化學式B_______ X_______
 名師導航單元期末沖刺100分系列答案
名師導航單元期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】以煉鋅廠的煙道灰![]() 主要成分為ZnO,另含少量
主要成分為ZnO,另含少量![]() 、CuO、
、CuO、![]() 、MnO等
、MnO等![]() 為原料可生產草酸鋅晶體ZnSO4·2H2O,摩爾質量為189g/mol。
為原料可生產草酸鋅晶體ZnSO4·2H2O,摩爾質量為189g/mol。

有關氫氧化物開始沉淀和沉淀完全的pH如下表:
氫氧化物 |
|
|
|
|
開始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
請問答下列問題:
(1)濾渣A的主要成分為_________,濾渣B的主要成分為_______________。
(2)除錳過程中產生![]() 沉淀的離子方程式為_______________________。
沉淀的離子方程式為_______________________。
(3) ①除鐵![]() 部分
部分![]() 可能被除去
可能被除去![]() 時加入ZnO控制反應液pH的范圍為______________。
時加入ZnO控制反應液pH的范圍為______________。
②若某溶液中含有![]() ,可能含有
,可能含有![]() ,請設計實驗證明
,請設計實驗證明![]() 的存在。________。
的存在。________。
(4)沉淀后要獲得干燥純凈草酸鋅晶體,需進行的操作是_______________。
(5)將草酸鋅晶體加熱分解可得到一種納米材料。加熱過程中固體殘留率隨溫度的變化如圖所示,![]() 范圍內,發生反應的化學方程式為_________________。
范圍內,發生反應的化學方程式為_________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為反應 2H2(g)+O2(g)=2H2O(g)的能量變化示意圖。 下列說法正確的是
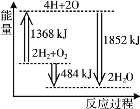
A.拆開 2 mol H2(g)和 1 mol O2(g)中的化學鍵成為H、O原子,共放出1368 kJ 能量
B.由 H、O 原子形成 2 mol H2O(g),共吸收1852 kJ 能量
C.2 mol H2(g)和 1 mol O2(g)反應生成 2 mol H2O(g),共放出484 kJ 能量
D.2 mol H2(g)和 1 mol O2(g)反應生成 2 mol H2O(l),ΔH>-484 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有某鐵碳合金(可看作鐵和碳兩種單質的混合物),某化學興趣小組為了測定鐵碳合金中碳的質量分數,設計了如圖所示的實驗裝置(夾持儀器已省略)。
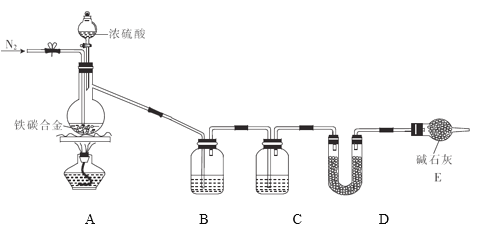
(1)裝置A中發生的反應除外![]() ,還有________________。
,還有________________。
(2)請完成下列表格:
裝置代號 | B | C | D |
所盛試劑 | 酸性 | ①________ | ②____________ |
裝置作用 | ③_____________ | 干燥氣體 | ④___________ |
(3)若鐵碳合金的質量為5.00g,充分反應后稱得D裝置增重0.66g,則合金中碳的質量分數為_______,若缺少E裝置,則所測碳的質量分數_________(填“偏高”“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,三種酸的電離平衡常數如下:
化學式 | CH3COOH | H2CO3 | HClO |
電離平衡常數 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列問題:
(1)一般情況下,當溫度升高時,Ka___(填“增大”、“減小”或“不變”)。
(2)下列四種離子結合質子能力由大到小的順序是___(填序號)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸餾水稀釋0.1mol/L的醋酸,下列各式表示的數值隨水量的增加而增大的是___(填序號)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常溫下,0.1mol/LNaHCO3溶液的pH大于8,則溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃時,若測得CH3COOH與CH3COONa的混合溶液的pH=6,則溶液中:
①![]() =___(填“精確數值”,下同)。
=___(填“精確數值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A為常見的金屬單質,根據如圖所示的關系:
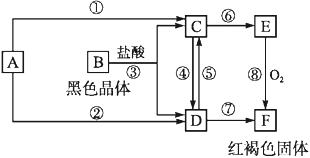
(1)確定C、E的化學式,C為_____,E為_____
(2)寫出④的離子方程式,⑧的化學方程式:
④_________________________,
⑧________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作合理或能達到實驗目的的是
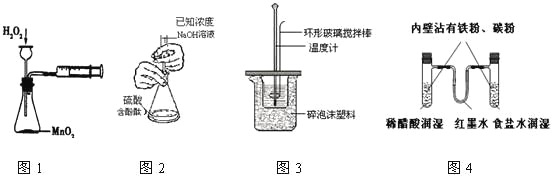
A.圖1:實驗目的是定量測定化學反應速率
B.圖2:用標準NaOH溶液滴定待測H2SO4溶液的物質的量濃度
C.圖3:將0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL鹽酸溶液中測中和熱
D.圖4:模擬鐵的腐蝕實驗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣凈化中的一個反應如下:2NO(g)+2CO(g)N2(g)+2CO2(g),請回答下列問題:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-l
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-l
則2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=____kJ·mol-l。
(2)一定溫度下,向體積為 1 L的密閉容器中充入一定量的NO和CO。在t1時刻達到平衡狀態,此時n(CO)=0.1 mol,n(NO)=0.2 mol,n(N2)= a mol,且N2占平衡總體積的![]() 。
。
①則該反應的平衡常數K=______。若保持溫度及容器體積不變,平衡后在此基礎上再向容器中充入3a mol的N2、0.2 mol的NO,平衡將______移動(填“向左”、“向右”或“不”)。
②下列各種情況,可說明該反應已經達到平衡的是______。
A.v生成(CO2)= v消耗(CO)
B.混合氣體的密度不再改變
C.混合氣體的平均相對分子質量不再改變
D.NO、CO、N2、CO2的濃度均不再變化
E.單位時間內生成2n mol碳氧雙鍵的同時消耗n molN≡N
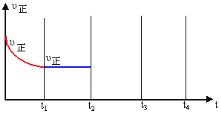
③在t2時刻,將容器迅速壓縮到原容積的![]() ,在其它條件不變的情況下, t3時刻達到新的平衡狀態。請在圖中補充畫出t2-t3-t4時段,正反應速率的變化曲線_________。
,在其它條件不變的情況下, t3時刻達到新的平衡狀態。請在圖中補充畫出t2-t3-t4時段,正反應速率的變化曲線_________。
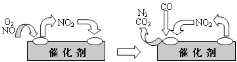
(3)為避免汽車尾氣中的有害氣體對大氣的污染,給汽車安裝尾氣凈化裝置。凈化裝置里裝有含Pd等過渡元素的催化劑,氣體在催化劑表面吸附與解吸作用的機理如下圖所示。寫出上述變化中的總化學反應方程式_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含硫酸鋁和氯化鋁的混合溶液中逐滴加入氫氧化鋇溶液至過量,加入氫氧化鋇溶液的體積和所得沉淀的物質的量的關系如圖所示。
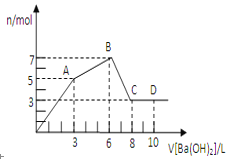
(1)氫氧化鋇溶液濃度為_____________________。
(2)原混合溶液中SO42-和Cl-的物質的量之比為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com