
科目: 來源: 題型:
【題目】用![]() 高能原子轟擊
高能原子轟擊![]() 的靶子,使鋅核與鉛核熔合,生成一個112號元素的原子的同時向外釋放出一個中子。下列說法錯誤的是
的靶子,使鋅核與鉛核熔合,生成一個112號元素的原子的同時向外釋放出一個中子。下列說法錯誤的是
A. 112號元素的相對原子質量為277
B. 此變化不屬于化學變化
C. 科學家合成的112號元素是金屬元素
D. 112號元素位于第七周期第ⅡB族
查看答案和解析>>
科目: 來源: 題型:
【題目】X、Z、Q、R、T、U分別代表原子序數依次增大的短周期元素,在周期表的短周期主族元素中,X的原子半徑最小,X與R的最外層電子數相等;Z的內層電子數是最外層電子數的一半;U的最高化合價和最低化合價的代數和為6;R和Q可形成原子個數之比為1:1和2:1的兩種化合物;T與Z同主族。請回答下列問題:
(1)T元素在周期表中的位置是________________________。
(2)X、Z、Q三種元素的原子半徑由小到大的順序為___________(填元素符號)。
(3)R、T兩元素最高價氧化物對應的水化物反應的化學方程式為____________。
(4)某同學用X、R兩元素的單質反應生成固體物質RX,RX屬于離子化合物,且能與化合物X2Q反應生成X的單質。
①RX的電子式為_____________;RX與X2Q反應的化學方程式為___________。
②該同學認為取X、R兩元素的單質反應后的固體物質與X2Q反應,若能產生![]() 的單質,即可證明得到的固體物質一定是純凈的RX。請判斷該方法是否合理并說明理由:_____________。
的單質,即可證明得到的固體物質一定是純凈的RX。請判斷該方法是否合理并說明理由:_____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】化學與生活生產密切相關。下列說法中錯誤的是
A.施肥時,銨態氮肥不能與草木灰(含K2CO3)混合使用
B.鋇中毒患者可盡快使用蘇打溶液洗胃,將Ba2+轉化為BaCO3而排出
C.夏天冰箱保鮮食品的原理是降低溫度,減慢化學反應速率
D.純堿溶液顯堿性,加熱去油污效果更佳。
查看答案和解析>>
科目: 來源: 題型:
【題目】丁苯酞是我國自主研發的一類用于治療急性缺血性腦卒的新藥。合成丁苯酞(J)的一種路線如圖所示:
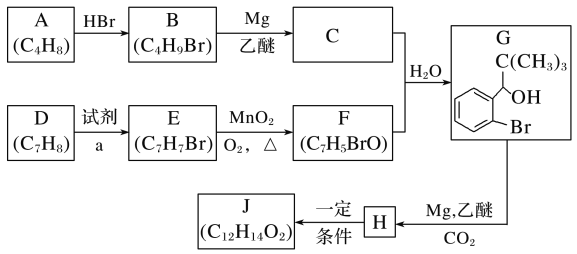
已知:
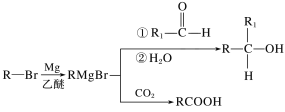
(1)B的化學名稱是__,F中官能團名稱是__。
(2)由E生成F的反應類型是__,由H生成J的反應類型是__。
(3)試劑a是__。
(4)J是一種環酯,則J的結構簡式為__。H在一定條件下還能生成高分子化合物K,H生成K的化學方程式為__。
(5)利用題中信息寫出以乙醛和苯為原料,合成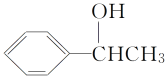 的流程圖(其他試劑自選)___。
的流程圖(其他試劑自選)___。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列圖像正確的是( )
A.向CaIOH)2和NaOH的混合溶液中通入CO2 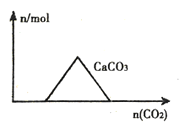
B.向1L濃度均為0.1mol/L的NaAlO2、Ba(OH)2的混合溶液中加入0.1mol/L的稀H2SO4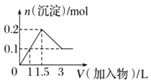
C.向1L濃度分別為0.1mol/L和0.3mol/L的AlCl3、NH4Cl的混合溶液中加入0.1mol/L的稀NaOH溶液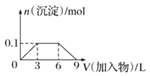
D.向氫氧化鈉溶液中滴加明礬溶液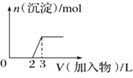
查看答案和解析>>
科目: 來源: 題型:
【題目】第四周期中的18種元素具有重要的用途,在現代工業中備受青睞。
(1)鉻是一種硬而脆、抗腐蝕性強的金屬,常用于電鍍和制造特種鋼。基態Cr原子中,電子占據最高能層的符號為__,該能層上具有的原子軌道數為__,電子數為__。
(2)第四周期元素的第一電離能隨原子序數的增大,總趨勢是逐漸增大的,30Zn與31Ga的第一電離能是否符合這一規律?__(填“是”或“否”)。
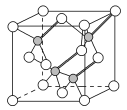
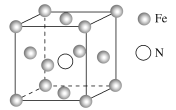
(3)鎵與第ⅤA族元素可形成多種新型人工半導體材料,砷化鎵(GaAs)就是其中一種,其晶體結構如圖所示(白色球代表As原子)。在GaAs晶體中,每個Ga原子與__個As原子相連,與同一個Ga原子相連的As原子構成的空間構型為__。
(4)與As同主族的短周期元素是N、P。AsH3中心原子雜化的類型__;一定壓強下將AsH3和NH3、PH3的混合氣體降溫時首先液化的是__,理由是__。
(5)鐵的多種化合物均為磁性材料,氮化鐵是其中一種,某氮化鐵的晶胞結構如圖所示,則氮化鐵的化學式為__;設晶胞邊長為acm,阿伏加德羅常數的值為NA,該晶體的密度為__g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目: 來源: 題型:
【題目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等離子。向該溶液中滴加NaOH溶液,生成沉淀的物質的量變化曲線如圖所示。下列有關判斷正確的是 ( )
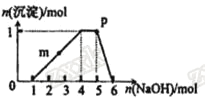
A.m點處反應:H++OH-=H2O
B.p點:c(OH-)>c(NH4+)>c(H+)
C.若取原溶液做焰色反應實驗,焰色應為黃色
D.原溶液中存在的主要離子:n(H+)=2n(NH4+)=n(Al3+)
查看答案和解析>>
科目: 來源: 題型:
【題目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20號主族元素,原子序數依次增大,
都是元素周期表中前20號主族元素,原子序數依次增大,![]() 是地殼中含量最高的元素,
是地殼中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氫化物及其最高價氧化物對應的水化物均為強酸,且
的氫化物及其最高價氧化物對應的水化物均為強酸,且![]() 、
、![]() 、
、![]() 的最高價氧化物對應的水化物兩兩混合均能發生反應生成鹽和水。據此回答下列問題:
的最高價氧化物對應的水化物兩兩混合均能發生反應生成鹽和水。據此回答下列問題:
(1)![]() 四種元素中,原子半徑最大的是______(填元素符號);
四種元素中,原子半徑最大的是______(填元素符號);![]() 和
和![]() 的簡單氫化物中,沸點較低的是______(填化學式)。
的簡單氫化物中,沸點較低的是______(填化學式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高價氧化物對應的水化物之間發生反應的化學方程式為____________________________________________________________。
的最高價氧化物對應的水化物之間發生反應的化學方程式為____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多種鹽,其中一種鹽中
可以形成多種鹽,其中一種鹽中![]() 、
、![]() 、
、![]() 三種元素的原子個數比為
三種元素的原子個數比為![]() ,該鹽的化學名稱為______。它的水溶液與
,該鹽的化學名稱為______。它的水溶液與![]() 的氫化物的水溶液反應可生成
的氫化物的水溶液反應可生成![]() 的單質,該反應的離子方程式______________________________,反應生成
的單質,該反應的離子方程式______________________________,反應生成![]() 的單質時,轉移電子______
的單質時,轉移電子______![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】甲醇是重要的有機化工原料,目前世界甲醇年產量超過2.1×107噸,在能源緊張的今天,甲醇的需求也在增大。甲醇的合成方法是:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列問題:
(1)甲醇的燃燒熱為__kJ·mol-1。
(2)在堿性條件下利用一氯甲烷(CH3Cl)水解也可制備少量的甲醇,該反應的化學方程式為__。
(3)若反應在密閉恒容絕熱容器中進行,反應(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1對合成甲醇反應中CO的轉化率的影響是(_________)
a.增大 b.減小 c.無影響 d.無法判斷
(4)在恒溫恒容的密閉容器中發生反應(ⅰ),各物質的濃度如下表:
濃度/mol·L-1 時間/min | c(CO) | c(H2) | c(CH3OH) |
0 | 0.8 | 1.6 | 0 |
2 | 0.6 | x | 0.2 |
4 | 0.3 | 0.6 | 0.5 |
6 | 0.3 | 0.6 | 0.5 |
①x=__。
②前2min內H2的平均反應速率為v(H2)=__。該溫度下,反應(ⅰ)的平衡常數K=__。(保留1位小數)
③反應進行到第2min時,改變了反應條件,改變的這個條件可能是(_________)
a.使用催化劑 b.降低溫度 c.增加H2的濃度
(5)如圖是溫度、壓強與反應(ⅰ)中CO轉化率的關系:
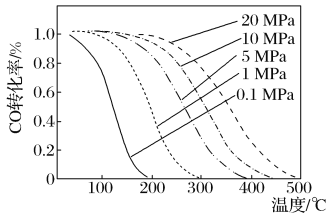
由圖像可知,溫度越低,壓強越大,CO轉化率越高,但實際生產往往采用300~400℃和10MPa的條件,其原因是__。
查看答案和解析>>
科目: 來源: 題型:
【題目】某化學課外活動小組為了驗證元素化學性質遞變規律,進行如下實驗探究。
Ⅰ.探究1:驗證同周期X、Y、Z三種元素金屬性遞變規律
實驗內容 | 實驗現象 |
1、各取1.0g金屬X和金屬Z,分別加入到5mL水中 | 金屬X與水反應比金屬Z劇烈 |
2、各取1.0g的金屬Z和金屬Y(形狀相同),分別加入到5mL1.0mol/L鹽酸中。 | 金屬Z與鹽酸反應比金屬Y劇烈 |
通過實驗驗證三種元素金屬性由強到弱是_____,則下列判斷正確的是(__________)
A.原子序數:Y>Z>X B.原子的最外層電子數X>Y>Z
C.原子半徑:Y>Z>X D.Y的最高價氧化物對應水化物的堿性最強
Ⅱ.探究2:驗證氯元素的非金屬性比硫元素的非金屬性強,設計如下實驗:
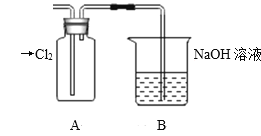
(1)裝置A中盛放的試劑是_______(填選項),化學反應方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于驗證氯元素比硫元素非金屬性強的依據為______(填選項)。
A.HCl比H2S穩定
B.HClO氧化性比H2SO4強
C.HClO4酸性比H2SO4強
D.鐵與Cl2反應生成FeCl3,而硫與鐵反應生成FeS
(3)若要驗證非金屬性:Cl>I,裝置A中加入淀粉碘化鉀混合溶液,觀察到裝置A中溶液_______的現象,即可證明。用原子結構理論解釋非金屬性Cl>I的原因:同主族元素從上到下,________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com