
科目: 來源: 題型:
【題目】向MgCl2、AlCl3的混合溶液中,開始滴加試劑X,之后改滴試劑Y,所得沉淀的物質的量n(mol)與試劑體積V(mL)間的關系如圖所示。以下結論錯誤的是( )
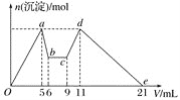
A.X是鹽酸,Y是NaOH溶液,且c(Y)=2c(X)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶1∶5
C.X是NaOH溶液,Y是鹽酸,且c(NaOH)∶c(HCl)=2∶1
D.從b至c相應的離子方程式為H++OH-===H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】氨硼烷(NH3·BH3)電池可在常溫下工作,裝置如圖所示。未加入氨硼烷之前,兩極室質量相等,電池反應為NH3·BH3+3H2O2=NH4BO2+4H2O。已知兩極室中電解質足量,下列說法正確的是( )
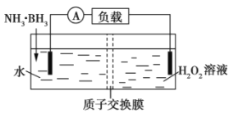
A.正極的電極反應式為2H++2e-═H2↑
B.電池工作時,H+通過質子交換膜向負極移動
C.電池工作時,正、負極分別放出H2和NH3
D.工作一段時間后,若左右兩極室質量差為1.9g,則電路中轉移0.6mol電子
查看答案和解析>>
科目: 來源: 題型:
【題目】某溶液中可能含有下列6種離子中的某幾種:Cl-、SO42-、CO32-、NH4+、Na+、K+。為確認溶液組成進行如下實驗:(1) 200 mL上述溶液,加入足量BaCl2溶液,反應后將沉淀過濾、洗滌、干燥,得沉淀4.30 g,向沉淀中加入過量的鹽酸,有2.33 g沉淀不溶。(2) 向(1)的濾液中加入足量的NaOH溶液,加熱,標準狀況下產生能使濕潤紅色石蕊試紙變藍的氣體1.12 L。由此可以得出關于原溶液組成的正確結論是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6種離子都存在,則c(Cl-)>c(SO42-)
查看答案和解析>>
科目: 來源: 題型:
【題目】高鐵酸鉀是一種新型、高效、多功能水處理劑,工業上采用向KOH溶液中通入氯氣,然后再加入![]() 溶液的方法制備
溶液的方法制備![]() ,發生反應:
,發生反應:
①![]() (未配平);
(未配平);
②![]() 。
。
下列說法正確的是
A.若反應①中![]() ,則氧化劑與還原劑的物質的量之比為2:1
,則氧化劑與還原劑的物質的量之比為2:1
B.反應①中每消耗4 mol KOH,吸收標準狀況下![]()
C.氧化性:![]()
D.若反應①的氧化產物只有KClO,則得到![]() 時消耗
時消耗![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】有關晶體的結構如圖所示,下列說法中不正確的是( )
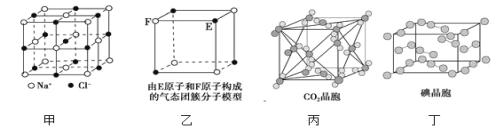
A.在NaCl晶體(圖甲)中,距Na+最近的C1-圍成正八面體
B.該氣態團簇分子(圖乙)的分子式為EF或FE
C.在CO2晶體(圖丙)中,一個CO2分子周圍有12個CO2分子緊鄰
D.在碘晶體(圖丁)中,存在的作用力有非極性共價鍵和范德華力
查看答案和解析>>
科目: 來源: 題型:
【題目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的幾種。①若加入鋅粒,產生無色無味的氣體;②若加入NaOH溶液,產生白色沉淀,且產生的沉淀量與加入NaOH的物質的量之間的關系如圖所示。則下列說法正確的是

A.溶液中的陽離子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2 mol
C.溶液中一定不含CO32-,可能含有SO42-和NO3-
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目: 來源: 題型:
【題目】某無色溶液中含有的陽離子為H+、Na+、Mg2+、Al3+、Ba2+中的一種或幾種,向該溶液中緩慢地滴入NaOH溶液直至過量,產生沉淀的質量與加入NaOH溶液的體積的關系如圖所示,由此確定原溶液中一定含有的陽離子是
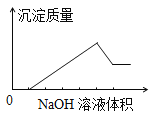
A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目: 來源: 題型:
【題目】設NA為阿伏加徳羅常數的值,下列說法正確的是
A.常溫下,1L pH=13的Ba(OH)2溶液中OH-數目為0.2NA
B.在電解精煉粗銅的過程中,當陰極質量增重32 g時轉移電子數目為NA
C.常溫常壓下,1 mol分子式為C2H6O的有機物中,含有C—O鍵的數目為NA
D.氫氧燃料電池正極消耗22.4L氣體時,負極消耗的氣體分子數目為2NA
查看答案和解析>>
科目: 來源: 題型:
【題目】下圖是實驗室制氯氣并進行一系列相關實驗的裝置(夾持及加熱儀器已略)。
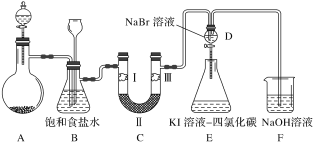
(1)制備氯氣選用的藥品為二氧化錳和濃鹽酸,則相關的化學反應方程式為:_____。
(2)裝置B中飽和食鹽水的作用是___________ 。
(3)裝置C的實驗目的是驗證氯氣是否具有漂白性,為此C中Ⅰ、Ⅱ、Ⅲ應依次放入_____。(填字母)
a | b | c | d | |
Ⅰ | 干燥的 有色布條 | 濕潤的 有色布條 | 濕潤的 有色布條 | 干燥的 有色布條 |
Ⅱ | 堿石灰 | 無水CaCl2 | 濃硫酸 | 無水CaCl2 |
Ⅲ | 濕潤的 有色布條 | 干燥的 有色布條 | 干燥的 有色布條 | 濕潤的 有色布條 |
(4)設計裝置D、E的目的是比較氯、溴、碘單質的氧化性強弱。當向D中緩緩通入一定量氯氣時,可以看到無色溶液逐漸變為橙黃色,打開D裝置中活塞,將D中少量溶液加入裝置E中,振蕩。觀察到的現象是_________。經認真考慮,有同學提出該實驗方案仍有不足,請說明其中原因___________。
(5)裝置F中用足量NaOH溶液吸收剩余的氯氣,試寫出相應的化學方程式:______。
查看答案和解析>>
科目: 來源: 題型:
【題目】利用膜技術原理和電化學原理制備少量硫酸和綠色硝化劑N2O5,裝置如圖所示,下列說法正確的是( )

A. 電極b反應式是O2+4e-+2H2O=4OH-
B. 電解后乙裝置d電極附近溶液的pH不變
C. c電極上的電極反應式為N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙裝置中有1mol H+通過隔膜
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com