
科目: 來源: 題型:
【題目】下列反應過程中不存在電子轉移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(濃)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(濃)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上常采用硝酸工業的含硝尾氣制備亞硝酸鈉,再利用亞硝酸鈉制備亞硝酸鉀,相關制備流程如下:
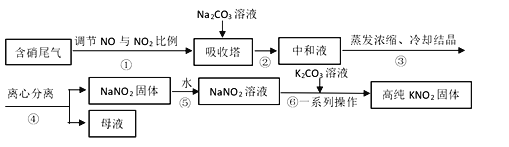
已知:①亞硝酸鈉(NaNO2)是一種白色至淺黃色晶體或粉末,受熱易分解,露置于空氣中緩慢氧化。
②KMnO4在中性或堿性溶液中的還原產物為MnO2,在酸性條件下為Mn2+。
請回答:
(1)下列操作或描述正確的是________。
A. 步驟①調節NO與NO2比例使尾氣被堿液充分吸收,且提高NaNO2產率
B. 在吸收塔中含硝尾氣從底部通入,Na2CO3溶液從塔頂噴淋
C. 母液中溶質只有Na2CO3和NaNO3
D. 所得NaNO2固體產品中含有雜質NaNO3
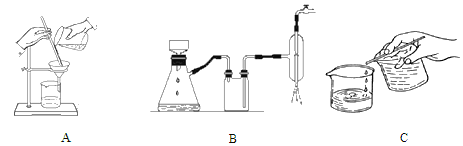
(2)離心分離是一種固液分離操作,步驟④可用以下三個操作中的________(選最佳)代替。
(3)NaNO2產品純度分析。若用NaNO2待測液滴定酸性KMnO4標準溶液,終點現象是___,測定結果與真實值非常接近;而采用酸性KMnO4標準液滴定NaNO2待測液的方法進行測定,根據滴定結果計算NaNO2產品純度總是大于100%,可能的原因是________。
(4)已知相關物質的溶解表如下:
物質 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
Na2CO3 | 7 | 21.5 | 49 | 46 | 43.9 |
K2CO3 | 105 | 111 | 117 | 127 | 140 |
NaNO2 | 71.2 | 80.8 | 94.9 | 111 | 113 |
KNO2 | 279 | 306 | 329 | 348 | 376 |
(i)根據相關物質溶解性信息,寫出步驟⑥的化學方程式________。
(ii)步驟⑥正確的操作順序為:b→_____→_____→c。
a 在85℃下蒸發濃縮,并不斷將析出的Na2CO3晶體撈出
b 將NaNO2溶液與K2CO3溶液充分混合
c 離心分離,在60~70℃下干燥,迅速冷卻,密封儲存
d 熱溶液冷卻結晶獲得高純KNO2
查看答案和解析>>
科目: 來源: 題型:
【題目】下圖是由常見元素組成的一些單質及其化合物之間的轉化關系圖。各方框表示有關的一種反應物或生成物(部分物質已經略去)。其中A、B、D在常溫下均為無色無味的氣體,C是能使濕潤的紅色石蕊試紙變藍的氣體,M是最常見的無色液體。

(1)寫出C→E的化學方程式: 。
(2)實驗室常用加熱兩種固體混合物的方法制備物質C,其化學方程式為: ,干燥C常用 (填寫試劑名稱)。
(3)E物質遇到D物質時,會觀察到 現象,若用排水法收集F,則最終集氣瓶中收集到的氣體為 (填寫物質的化學式)。
(4)寫出A→D的化學方程式: 。
查看答案和解析>>
科目: 來源: 題型:
【題目】根據下圖所示的轉化關系,回答下列問題:

(1)寫出反應①的離子方程式:______________________________________________;寫出反應②的離子方程式:______________________。
(2)推出下列物質的化學式:E____________;I______________。
(3)在上述轉化過程中,B、C、F、H的氧化能力由弱到強的順序為______________________(寫化學式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖是中學化學中常見物質之間的一些反應關系,其中部分產物未寫出。常溫下X是固體,B和G是液體,其余均為氣體。根據下圖關系推斷:

(1)寫出化學式:X_______,A________,B_______。
(2)實驗室收集氣體D和F的方法依次是_______法、________法。
(3)寫出C→E的化學方程式:____________。
(4)請寫出A與E反應生成D的化學方程式:_______________
(5)檢驗物質A的方法和現象是________________
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室用少量的溴水和足量的乙烯制備1,2-二溴乙烷的裝置如圖所示:
有關數據列表如下:
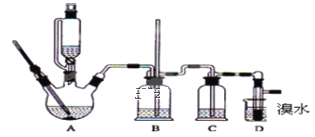
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
狀態 | 無色液體 | 無色液體 | 無色液體 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸點/℃ | 78.5 | 132 | 34.6 |
熔點/℃ | -l30 | 9 | -1l6 |
回答下列問題:
(1)燒瓶A中發生的主要的反應方程式:___________________________________。
(2)安全瓶B可以防倒吸,并可以檢查實驗進行時試管D是否發生堵塞.請寫出發生堵塞時瓶B中的現象:______________________________________________________。
(3)在裝置C中應加入_____(填字母),(a.水 b.濃硫酸 c.氫氧化鈉溶液)其目的是 ___________________________________________________________________。
(4)若產物中有少量副產物乙醚,可用 ________________ 的方法除去。
(5)反應過程中應用冷水冷卻裝置D,但又不能過度冷卻(如用冰水),其原因是 _________________________________________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】以天然氣為原料合成氨是現代合成氨工業發展的方向與趨勢
(一)天然氣與氮氣為原料,以固態質子交換膜為電解質,在低溫常壓下通過電解原理制備氨氣如圖所示:
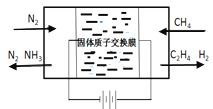
寫出在陰極表面發生的電極反應式:_____________。
(二)天然氣為原料合成氨技術簡易流程如下:

一段轉化主要發生的反應如下:
①CH4(g) +H2O(g) ![]() CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
二段轉化主要發生的反應如下:
③2CH4(g)+ O2(g) ![]() 2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
④2CO(g) + O2(g) ![]() 2CO2(g) ΔH4 = -282 kJ·molˉ1
2CO2(g) ΔH4 = -282 kJ·molˉ1
(1)已知CO中不含C=O,H-H的鍵能為436 kJ·molˉ1,H-O的鍵能為463 kJ·molˉ1,C-H的鍵能為414 kJ·molˉ1,試計算C=O的鍵能_________。
(2)實驗室模擬一段轉化過程,在800oC下,向體積為1L的恒容密閉反應器中,充入1mol的CH4與1mol的H2O,達到平衡時CH4的轉化率為40%,n(H2)為1.4mol,請計算反應②的平衡常數_________。
(3)下列說法正確的是_________。
A.合成氨過程實際選擇的溫度約為700℃,溫度過高或過低都會降低氨氣平衡產率
B.上述工業流程中壓縮既能提高反應速率又能提高合成氨的產率
C.二段轉化釋放的熱量可為一段轉化提供熱源,實現能量充分利用
D.二段轉化過程中,需嚴格控制空氣的進氣量,否則會破壞合成氣中的氫氮比
(4)已知催化合成氨中催化劑的活性與催化劑的負載量、催化劑的比表面積和催化反應溫度等因素有關,如圖所示:

①實驗表明相同溫度下,負載量5%催化劑活性最好,分析負載量9%與負載量1%時,催化劑活性均下降的可能原因是________。
②在上圖中用虛線作出負載量為3%的催化劑活性變化曲線_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】某學習小組對液態有機物M進行如下探究實驗。請回答:
Ⅰ.M組成的探究
取6.2 g有機物M在足量O2中完全燃燒后,將生成 物全部通入如圖1所示裝置(夾持裝置略去),則:
(1)若不考慮尾氣處理,該裝置還有一個明顯不足為____________________________。
(2)若不考慮其他因素,且生成物在A、B中全部被吸收,測得裝置A增重5.4 g,裝置B增重8.8 g,M的實驗式為___________________,分子式為_______________________。
Ⅱ.M結構的探究
為確定M的官能團,該小組設計如圖2所示裝置(加持裝置略)進行實驗,步驟為:
①準確量取2.79 mL ρ=1.11 g·mL-1的M加入分液漏斗中;
②打開分液漏斗活塞,當M恰好全部加入a中時,迅速關閉分液漏斗活塞;
③a中反應完全后,準確讀取量筒中液體體積。
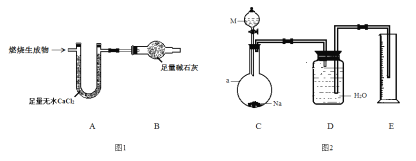
(3)a儀器的名稱為__________;伸入量筒中的導管 ____(填“長”或“短”)些更合理。
(4)實驗前,檢驗C、D部分裝置氣密性的方法為____________________________。
(5)第③步中,準確讀取量筒讀數,注意的事項為冷至室溫、__________________和_____________________________。
(6)下列各項,可能導致所測氣體體積偏大的為__________(填選項字母)。
A.所取M中含有少量水
B.裝置C中Na過量
C.裝置D、E間導管中的水沒有排入量筒中
D.分液漏斗中液體M加入儀器a,將a中部分氣體排入D
(7)若量筒中水的體積轉化為標準狀況下氣體體積為560 mL,裝置C中反應的化學方程式為______________________________________________(有機物用結構簡式表示)。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;現要將
>HCO3-;現要將![]() 轉變為
轉變為 ![]() ,可行的方法是
,可行的方法是
A.向該溶液中加入足量的稀硫酸,加熱
B.將該物質與稀硫酸共熱后,再加入足量的NaOH溶液
C.將該物質與足量的NaOH溶液共熱,再通入足量CO2氣體
D.將該物質與稀硫酸共熱后,再加入足量的Na2CO3溶液
查看答案和解析>>
科目: 來源: 題型:
【題目】將200mL CuSO4和Fe2(SO4)3的混合溶液分成兩等份,向其中一份加入足量鐵粉,充分反應后測得固體質量保持不變;向另一份中加入足量BaCl2溶液,經過濾、洗滌、干燥、稱量,得到23.3g白色沉淀。請計算:
(1)原溶液中c(SO42-) = __________。
(2)原溶液中CuSO4和Fe2(SO4)3的物質的量比為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com