
科目: 來源: 題型:
【題目】用軟錳礦(主要成分為MnO2,含少量Fe3O4、Al2O3)和BaS制備高純MnCO3的工藝流程如下:
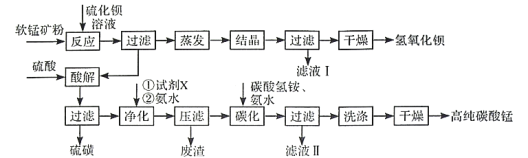
已知:MnO2是一種兩性氧化物;25℃時相關物質的Ksp見下表。
物質 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp |
|
|
|
|
回答下列問題
(1)軟錳礦預先粉碎的目的是____________,MnO2與BaS溶液反應轉化為MnO的化學方程式為________。
(2)保持BaS投料量不變,隨MnO2與BaS投料比增大,S的量達到最大值后無明顯變化,而Ba(OH)2的量達到最大值后會減小,減小的原因是________。
(3)濾液I可循環使用,應當將其導入到________操作中(填操作單元的名稱)。
(4)凈化時需先加入的試劑X為________(填化學式)。再使用氨水調溶液的pH,則pH的理論最小值為_______(當溶液中某離子濃度![]() 時,可認為該離子沉淀完全)。
時,可認為該離子沉淀完全)。
(5)碳化過程中發生反應的離子方程式為______________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】![]() 溶液與
溶液與![]() 鋅粉在量熱計中充分反應。測得反應前溫度為
鋅粉在量熱計中充分反應。測得反應前溫度為![]() ,反應后最高溫度為
,反應后最高溫度為![]() 。
。
已知:反應前后,溶液的比熱容均近似為![]() 、溶液的密度均近似為
、溶液的密度均近似為![]() ,忽略溶液體積、質量變化和金屬吸收的熱量。請計算:
,忽略溶液體積、質量變化和金屬吸收的熱量。請計算:
(1)反應放出的熱量![]() _____J。
_____J。
(2)反應![]() 的
的![]() ______
______![]() (列式計算)。
(列式計算)。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均為C6H6,下列說法正確的是
的分子式均為C6H6,下列說法正確的是
A. b的同分異構體只有d和p兩種B. b、d、p的二氯代物均只有三種
C. b、d、p均可與酸性高錳酸鉀溶液反應D. b、d、p中只有b的所有原子處于同一平面
查看答案和解析>>
科目: 來源: 題型:
【題目】現用質量分數為98%、密度為1.84 g·cm-3的濃H2SO4來配制500 mL、0.2 mol·L-1的稀H2SO4。可供選擇的儀器有:①玻璃棒 ②燒瓶 ③燒杯 ④膠頭滴管 ⑤量筒 ⑥容量瓶 ⑦托盤天平 ⑧藥匙。請回答下列問題:
(1)上述儀器中,在配制稀H2SO4時用不到的有__________(填代號)。
(2)經計算,需濃H2SO4的體積為____________。現有①10 mL ②50 mL ③100 mL三種規格的量筒,你選用的量筒是__________(填代號)。
(3)將濃H2SO4加適量蒸餾水稀釋后,冷卻片刻,隨后全部轉移到__________ mL的容量瓶中,轉移時應用玻璃棒__________。轉移完畢,用少量蒸餾水洗滌__________2~3次,并將洗滌液全部轉移到容量瓶中,再加適量蒸餾水,振蕩容量瓶,使溶液混合均勻。然后緩緩地把蒸餾水直接注入容量瓶直到液面接近刻度__________處。改用__________加蒸餾水到瓶頸刻度的地方,使溶液的__________。振蕩、搖勻后,裝瓶、貼簽。
(4)在配制過程中,其他操作都準確,下列操作中:錯誤的是_______,能引起誤差偏高的有______(填代號)。
①洗滌量取濃H2SO4后的量筒,并將洗滌液轉移到容量瓶中
②未等稀釋后的H2SO4溶液冷卻至室溫就轉移到容量瓶中
③將濃H2SO4直接倒入燒杯,再向燒杯中注入蒸餾水來稀釋濃H2SO4
④定容時,加蒸餾水超過標線,又用膠頭滴管吸出
⑤轉移前,容量瓶中含有少量蒸餾水
⑥定容搖勻后,發現液面低于標線,又用膠頭滴管加蒸餾水至標線
⑦定容時,俯視標線
查看答案和解析>>
科目: 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值。下列說法正確的是
A.1mol的羥基與1mol的氫氧根離子所含電子數均為9NA
B.常溫常壓下,18g H2O含有的原子總數為3NA
C.標準狀況下,11.2LCH3CH2OH中含有分子的數目為0.5NA
D.常溫常壓下,2.24LCO和CO2混合氣體中含有的碳原子數目為0.1NA
查看答案和解析>>
科目: 來源: 題型:
【題目】白藜蘆醇廣泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能夠與1 mol該化合物發生反應的Br2和H2的最大用量分別是( )
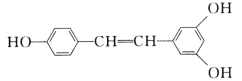
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法正確的是
A.32![]() 中含有的氧原子數是2×6.02×1023
中含有的氧原子數是2×6.02×1023
B.N2和CO共1mol的混合氣體中含有的分子總數是2×6.02×1023
C.2.3 g Na與O2完全反應生成3.6 g產物時失電子數是0.1×6.02×1023
D.1.0 L 0.1 mol·L-1NH4NO3溶液中含有的銨根離子數是0.1×6.02×1023
查看答案和解析>>
科目: 來源: 題型:
【題目】硫代硫酸鈉在紡織業等領域有廣泛應用。某興趣小組用下圖裝置制備![]() 。
。
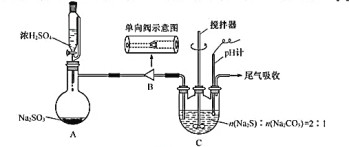
合成反應:![]()
![]()
![]()
滴定反應:![]()
已知:![]() 易溶于水,難溶于乙醇,
易溶于水,難溶于乙醇,![]() 開始失結晶水。
開始失結晶水。
實驗步驟:
Ⅰ.![]() 制備:裝置A制備的
制備:裝置A制備的![]() 經過單向閥通入裝置C中的混合溶液,加熱、攪拌,至溶液
經過單向閥通入裝置C中的混合溶液,加熱、攪拌,至溶液![]() 約為7時,停止通入
約為7時,停止通入![]() 氣體,得產品混合溶液。
氣體,得產品混合溶液。
Ⅱ.產品分離提純:產品混合溶液經蒸發濃縮、冷卻結晶、過濾洗滌、干燥,得到![]() 產品。
產品。
Ⅲ.產品純度測定:以淀粉作指示劑,用![]() 產品配制的溶液滴定碘標準溶液至滴定終點,計算
產品配制的溶液滴定碘標準溶液至滴定終點,計算![]() 含量。
含量。
請回答:
(1)步驟Ⅰ:單向閥的作用是______;裝置C中的反應混合溶液![]() 過高或過低將導致產率降低,原因是_______。
過高或過低將導致產率降低,原因是_______。
(2)步驟Ⅱ:下列說法正確的是_____。
A 快速蒸發溶液中水分,可得較大晶體顆粒
B 蒸發濃縮至溶液表面出現品晶膜時,停止加熱
C 冷卻結晶后的固液混合物中加入乙醇可提高產率
D 可選用冷的![]() 溶液作洗滌劑
溶液作洗滌劑
(3)步驟Ⅲ
①滴定前,有關滴定管的正確操作為(選出正確操作并按序排列):
檢漏→蒸餾水洗滌→(______)→(______)→(______)→(______)→(______)→開始滴定。
A 烘干 B 裝入滴定液至零刻度以上 C 調整滴定液液面至零刻度或零刻度以下D 用洗耳球吹出潤洗液 E 排除氣泡 F 用滴定液潤洗2至3次 G 記錄起始讀數
②裝標準碘溶液的碘量瓶(帶瓶塞的錐形瓶)在滴定前應蓋上瓶塞,目的是______。
③滴定法測得產品中![]() 含量為
含量為![]() ,則
,則![]() 產品中可能混有的物質是________。
產品中可能混有的物質是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com