
科目: 來源: 題型:
【題目】CO、NH3是工業生產中的常用氣體,研究其在工業上的反應過程對提高生產效率尤為重要。
I.工業上用CO和H2做原料可以合成甲醇,作為液體燃料。已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
(1)請寫出用CO(g)和H2(g)合成1mol液態甲醇的熱化學反應方程式:______________。
(2)一定溫度下,在容積為2L的恒容容器中加入3mol H2和2mol CO,當反應2H2(g)+CO(g)![]() CH3OH(g)達到平衡時,測得容器內的壓強是反應前壓強的
CH3OH(g)達到平衡時,測得容器內的壓強是反應前壓強的![]() ,計算得該溫度下反應的平衡常數K=____________。保持恒溫恒容,向上述達到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)濃度均為原平衡的2倍,則平衡移動方向為________移動(填“正向”、“逆向”或“不”)。
,計算得該溫度下反應的平衡常數K=____________。保持恒溫恒容,向上述達到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)濃度均為原平衡的2倍,則平衡移動方向為________移動(填“正向”、“逆向”或“不”)。
II.對于氨的合成反應 N2(g)+3H2(g)![]() 2NH3(g) △H<0,在密閉容器內充入0.1mol/L N2和0.3 mol/L H2。反應中NH3的物質的量濃度的變化情況如下圖,試回答問題:
2NH3(g) △H<0,在密閉容器內充入0.1mol/L N2和0.3 mol/L H2。反應中NH3的物質的量濃度的變化情況如下圖,試回答問題:
(3)恒容條件下,從開始反應到建立起平衡狀態,v(N2)=_________;反應達到平衡后,第5分
鐘末只改變反應溫度,保持其它條件不變,則改變條件后NH3的物質的量濃度不可能為_____。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(4)在第5分鐘時將容器的體積縮小一半,反應在第8分鐘時達到新的平衡,此時NH3的濃度約為0.30 mol/L。請在上圖中畫出第5分鐘之后的NH3濃度的變化曲線______。
(5)其它條件不變,若只把容器改為恒壓容器,加入0.2 molN2和0.6 molH2,達到平衡時,NH3的體積分數為m%。若向容器中繼續加入0.2 molN2和0.6 molH2,,在同樣的溫度下達到平衡時,NH3的體積分數為n%,則m和n的關系正確的是______。
A.m>n B.m<n C.m=n D.無法比較%
查看答案和解析>>
科目: 來源: 題型:
【題目】天然氣的主要成分為CH4,一般還含有C2H6等烴類,是重要的燃料和化工原料。
(1)乙烷在一定條件可發生如下反應:C2H6(g)= C2H4(g)+H2(g) ΔH,相關物質的燃燒熱數據如下表所示:
物質 | C2H6(g) | C2H4(g) | H2(g) |
燃燒熱ΔH/( kJ·mol1) | -1560 | -1411 | -286 |
①ΔH=_________kJ·mol1。
②提高該反應平衡轉化率的方法有_________、_________。
③容器中通入等物質的量的乙烷和氫氣,在等壓下(p)發生上述反應,乙烷的平衡轉化率為α。反應的平衡常數Kp=_________(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(2)高溫下,甲烷生成乙烷的反應如下:2CH4![]() C2H6+H2。反應在初期階段的速率方程為:r=k×
C2H6+H2。反應在初期階段的速率方程為:r=k×![]() ,其中k為反應速率常數。
,其中k為反應速率常數。
①設反應開始時的反應速率為r1,甲烷的轉化率為α時的反應速率為r2,則r2=_____ r1。
②對于處于初期階段的該反應,下列說法正確的是_________。
A.增加甲烷濃度,r增大 B.增加H2濃度,r增大
C.乙烷的生成速率逐漸增大 D.降低反應溫度,k減小
(3)CH4和CO2都是比較穩定的分子,科學家利用電化學裝置實現兩種分子的耦合轉化,其原理如下圖所示:
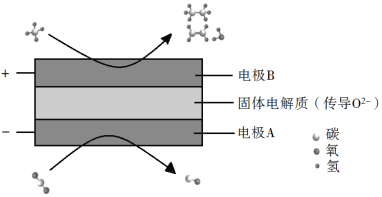
①陰極上的反應式為_________。
②若生成的乙烯和乙烷的體積比為2∶1,則消耗的CH4和CO2體積比為_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某研究性學習小組,在做Na2O2與水反應實驗時,發現Na2O2與水反應后的溶液中滴加酚酞試液溶液呈現紅色,但紅色很快褪色,甲、乙、丙三同學對此現象分別做了如下推測:
甲:因為反應后試管很熱,所以可能是溶液溫度較高使紅色褪去。
乙:因為所加水的量較少,紅色褪去可能是生成的NaOH溶液濃度較大的影響。
丙:Na2O2具有強氧化性,生成物中O2、H2O(可能產物)等也具有強氧化性,氧化漂白了紅色物質。
(1)驗證甲同學的推測是否正確的方法是_________,驗證乙同學的推測是否正確的方法是_________,當出現_________現象時,即說明丙同學的推測正確。
(2)有同學提出用定量的方法探究丙同學方案中是否含有出O2,其實驗方法為:稱取2.6g Na2O2固體,使之與足量的水反應,測量產生O2的體積,與理論值比較,即可得出結論。
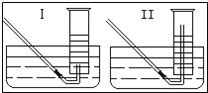
①測量氣體體積時,必須待試管和量筒內的氣體都冷卻至室溫時進行,應選用上圖裝置中的_______,理由是________。
②若在標準狀況下測量氣體的體積,應選用量筒的大小規格為______(選填“l00mL”、“200mL”、“500mL”或“l000mL”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學用下列裝置檢驗Cl2的性質。
|
|
|
Ⅰ |
| Ⅲ |
(1)I圖中退色的是______(填“a”或“b”),I圖燒杯中發生反應的離子方程式是______。
(2)Ⅱ圖中的現象是_________。
(3)將銅絲換成鐵絲,做Ⅱ實驗,結果也能點燃,你認為鐵絲也能點燃的理由是_______(填選項字母)。
A Fe與Cu都是金屬元素 B Fe的熔點比Cu高
C Fe的密度比Cu小 D Fe的性質比Cu活潑
(4)將Ⅲ裝置放置在光亮的地方(日光沒有直接照射),一會兒后,量筒內黃綠色氣體顏色變淺,量筒內液面上升等。(混合氣中氫氣含量為60%),己知:氫氣含量超過52.8%,光照不會發生爆炸)
①量筒中液面上升的原因是_________。
②水槽用飽和食鹽水而不用水的原因是_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】CaCO3與稀鹽酸反應(放熱反應)生成CO2的量與反應時間的關系如右圖所示。下列結論不正確的是( )

A. 反應開始4 min內溫度對反應速率的影響比濃度大
B. 一段時間后,反應速率減小的原因是c(H+)減小
C. 反應在2~4 min內平均反應速率最大
D. 反應在2~4 min內生成CO2的平均反應速率為v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)已知鐵的相對原子質量是56 ,則1個鐵原子的質量是_______g。(用NA表示)
(2)在標準狀況下,1.7g氨氣所占的體積為_______L,它與標準狀況下_____L硫化氫含有相同數目的氫原子。
(3)已知CO、CO2的混合氣體質量共16.0g,標準狀況下體積為8.96L,則可推知該取混合氣體中含CO____g,所含CO2在標袱狀況下的體積為__________L。
(4)同溫同壓下同體積的H2和A氣體的質量分別是0.2g和l.6g,則氣體A的摩小質量為________,含有A的分子個數為________。(用NA表示)
(5)標準狀況下的aLHCl(g)溶于1000g水中,得到的鹽酸密度為bg·cm-3,則該鹽酸的物質的量濃度是_____mol·L-1
查看答案和解析>>
科目: 來源: 題型:
【題目】化學工業為疫情防控提供了強有力的物質支撐。氯的許多化合物既是重要化工原料,又是高效、廣譜的滅菌消毒劑。回答下列問題:
(1)氯氣是制備系列含氯化合物的主要原料,可采用如圖(a)所示的裝置來制取。裝置中的離子膜只允許______離子通過,氯氣的逸出口是_______(填標號)。
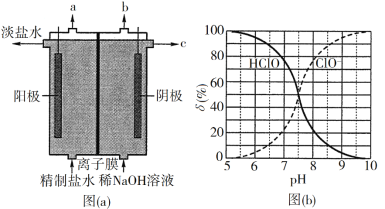
(2)次氯酸為一元弱酸,具有漂白和殺菌作用,其電離平衡體系中各成分的組成分數δ[δ(X)=![]() ,X為HClO或ClO]與pH的關系如圖(b)所示。HClO的電離常數Ka值為______。
,X為HClO或ClO]與pH的關系如圖(b)所示。HClO的電離常數Ka值為______。
(3)Cl2O為淡棕黃色氣體,是次氯酸的酸酐,可由新制的HgO和Cl2反應來制備,該反應為歧化反應(氧化劑和還原劑為同一種物質的反應)。上述制備Cl2O的化學方程式為______。
(4)ClO2常溫下為黃色氣體,易溶于水,其水溶液是一種廣譜殺菌劑。一種有效成分為NaClO2、NaHSO4、NaHCO3的“二氧化氯泡騰片”,能快速溶于水,溢出大量氣泡,得到ClO2溶液。上述過程中,生成ClO2的反應屬于歧化反應,每生成1 mol ClO2消耗NaClO2的量為_____mol;產生“氣泡”的化學方程式為____________。
(5)“84消毒液”的有效成分為NaClO,不可與酸性清潔劑混用的原因是______(用離子方程式表示)。工業上是將氯氣通入到30%的NaOH溶液中來制備NaClO溶液,若NaClO溶液中NaOH的質量分數為1%,則生產1000 kg該溶液需消耗氯氣的質量為____kg(保留整數)。
查看答案和解析>>
科目: 來源: 題型:
【題目】一種由短周期主族元素組成的化合物(如圖所示),具有良好的儲氫性能,其中元素W、X、Y、Z的原子序數依次增大、且總和為24。下列有關敘述錯誤的是
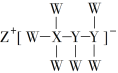
A.該化合物中,W、X、Y之間均為共價鍵
B.Z的單質既能與水反應,也可與甲醇反應
C.Y的最高化合價氧化物的水化物為強酸
D.X的氟化物XF3中原子均為8電子穩定結構
查看答案和解析>>
科目: 來源: 題型:
【題目】將0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和純水混合,要使混合液中K+ 、Al3+、 SO42-的濃度分別為0.1mol/L、0.1mol/L、0.2mol/L,則所取三者的體積比是(假定混合后的體積不變)( )
A.1:1:1 B.2:1:2 C.1:1:2 D.2:1:1
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法中不正確的是
A.常溫常壓下,28gCO與N2的混合氣體所含有的原子數為2NA
B.6.02×1023個氮分子和6.02×1023個氫分子的質量比等于14:1
C.同溫同壓下,相同質量的二氧化碳和二氧化硫的體積是16:11
D.常溫常壓下,0.5×6.02×1023一氧化碳分子所占體積是11.2L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com