
科目: 來源: 題型:
【題目】某化學小組同學探究在實驗室中![]() 檢驗的干擾因素。
檢驗的干擾因素。
(1)檢驗溶液中是否含有![]() 時先用過量鹽酸將溶液酸化,其目的是排除_______________、
時先用過量鹽酸將溶液酸化,其目的是排除_______________、![]() 、Ag+等離子可能造成的干擾。
、Ag+等離子可能造成的干擾。
(2)為了驗證鹽酸能否排除![]() 的干擾,該小組同學進行了如下實驗:
的干擾,該小組同學進行了如下實驗:
Ⅰ.量取一定體積的濃鹽酸(盛放濃鹽酸試劑瓶的標簽中部分信息如下圖),稀釋,配制成 5 mol/L 的稀鹽酸。

Ⅱ.甲同學取 0.3 g 未變質的 Na2SO3 固體,向其中加入上述 5mol/L 稀鹽酸至過量,產生大量氣泡。充分振蕩后滴加 4 滴BaCl2 溶液,迅速產生白色渾濁,產生白色渾濁的原因可能是:
①______________。
②鹽酸中含有 Fe3+,實驗證實含有 Fe3+的方案是:___________________,用離子方程式解釋由 Fe3+產生白色渾濁的原因:__________。
(3)乙同學提出,檢驗![]() 時能否用硝酸酸化來排除
時能否用硝酸酸化來排除![]() 的干擾,丙同學認為不可行,理由是(用離子方程式表示)____________________________,繼續實驗:稱取 5 份 0.3 g 未變質的Na2SO3 固體,分別向其中加入 10 mL 不同濃度的硝酸, 振蕩;再滴加 4 滴BaCl2 溶液,觀察并記錄實驗現象如下表。
的干擾,丙同學認為不可行,理由是(用離子方程式表示)____________________________,繼續實驗:稱取 5 份 0.3 g 未變質的Na2SO3 固體,分別向其中加入 10 mL 不同濃度的硝酸, 振蕩;再滴加 4 滴BaCl2 溶液,觀察并記錄實驗現象如下表。
硝酸濃度(mol/L) | 滴加氯化鋇溶液之前現象 | 滴加氯化鋇溶液之后現象 |
15.0(濃硝酸) | 產生大量紅棕色氣體,溶液呈黃色 | 立即產生大量白色沉淀 |
7.5 | 產生大量紅棕色氣體,溶液呈淡黃色 | 立即產生大量白色沉淀 |
4.8 | 產生少量無色、刺激性氣味氣體,溶液無色 | 開始無現象,約 60 min 后溶液開始變渾濁 |
2.0 | 產生少量無色、刺激性氣味氣體,溶液無色 | 開始無現象,約 70 min 后溶液開始變渾濁 |
0.5 | 產生少量無色、刺激性氣味氣體,溶液無色 | 開始無現象,約 120 min 后溶液開始變渾濁 |
依據上述實驗得出的結論是:________________。
(4)丙同學查閱資料后提出:Cl-的存在也會對![]() 的檢驗產生干擾。在 Cl-催化作用下,稀硝酸可將
的檢驗產生干擾。在 Cl-催化作用下,稀硝酸可將![]() 氧化為
氧化為 ![]() 。為證明上述觀點,設計如下實驗,請將實驗ⅱ的操作補充完整。
。為證明上述觀點,設計如下實驗,請將實驗ⅱ的操作補充完整。
實驗 | 實驗操作 | 實驗現象 |
ⅰ | 將 0.3 g Na2SO3 和 0.3 g NaCl 固體混合,加入 10 mL 2.0mol/L 的稀硝酸,振蕩后,再滴加 4 滴 BaCl2 溶液。 | 立即產生大量白色沉淀。 |
ⅱ | ____________。 | 放置兩小時后溶液未變渾濁。 |
查看答案和解析>>
科目: 來源: 題型:
【題目】在氯水中存在多種分子和離子,它們在不同的反應中表現各自的性質.下列實驗現象和結論一致且正確的是
A. 加入有色布條,一會兒有色布條褪色,說明溶液中有Cl2存在
B. 溶液呈黃綠色,且有刺激性氣味,說明有HClO分子存在
C. 加入AgNO3溶液產生白色沉淀,說明有Cl-分子存在
D. 加入NaOH溶液,氯水黃綠色消失,說明有HClO分子存在
查看答案和解析>>
科目: 來源: 題型:
【題目】Fe3O4又稱為磁性氧化鐵,常用來制造錄音磁帶和電訊器材。其Fe(II)和Fe(III)的比值是評判磁粉質量優劣的重要指標,測定方法如下(雜質不含干擾測定):
I.準確稱量mg磁粉樣品溶于過量稀硫酸,配制成250.00mL溶液;
II.取25.00mL上述溶液,用0.0200mol/LKMnO4溶液滴定,消耗KMnO4溶液V1mL;
III.另取I溶液25.00mL,加入30%過氧化氫溶液,微熱至無氣泡后冷卻至室溫;
IV.向Ⅲ所得溶液中加入過量KI,密閉反應30min;
V.用0.3000mol/LNa2S2O3標準溶液滴定Ⅳ中溶液至淺黃色時,滴加2滴淀粉溶液,繼續滴定至終點,共消耗Na2S2O3溶液V2mL。
已知:I2 + 2Na2S2O3 = 2NaI + Na2S4O6,Na2S2O3 和 Na2S4O6 溶液顏色均為無色
(1)Ⅰ中配制溶液用到的玻璃儀器有燒杯、玻璃棒、____________和______________。
(2)Ⅱ中發生反應的離子方程式是_____________。
(3)Ⅲ中加過氧化氫溶液時一定要過量,理由是______________。
(4)V 中滴定至終點的現象是_______________。
(5)磁粉中 Fe(II)和Fe(III)的物質的量之比為___________(寫出計算式即可)。
查看答案和解析>>
科目: 來源: 題型:
【題目】將1.12 g鐵粉加入25 mL 2mol/L的氯化鐵溶液中,充分反應后,其結果是
A. 鐵有剩余,溶液呈淺綠色,Cl- 濃度基本不變
B. 往溶液中滴入無色KSCN溶液,顯黃色
C. 氧化產物與還原產物的物質的量之比為2∶5
D. Fe2+和Fe3+的物質的量之比為6∶1
查看答案和解析>>
科目: 來源: 題型:
【題目】甲醇是種非常重要的化工原料,工業上CO2 用于生產燃料甲醇,既能緩解溫室效應,也為甲醇的合成尋找了新渠道。
(1)甲醇的合成:合成甲醇的反應為:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H ;在催化劑作用下,測得甲醇的產率與反應溫度、壓強關系如下圖所示, 由圖中數據可知,△H______0(選 填“>”“<”“=”),甲醇產率隨著壓強變化呈現圖示規律的原因是_______。
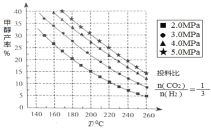
(2)甲醇的應用:丙炔酸甲酯是一種重要的有機化工原料,不溶于水,常溫呈液態,沸點為 103~105 ℃。實驗室可用甲醇和另一有機原料 M 在一定條件下制備,實驗步驟如下:
步驟 1:在反應瓶中,加入 13 g 原料 M、50 mL 甲醇和 2 mL 濃硫酸,攪拌,加熱回流一段時間。
步驟 2:蒸出過量的甲醇(裝置見下圖)。
步驟 3:反應液冷卻后,依次用飽和 NaCl 溶液、 5%Na2CO3 溶液、水洗滌;分離出有機相。
步驟 4:有機相經無水 Na2SO4 干燥、過濾、蒸餾, 得丙炔酸甲酯。

①步驟 1 中反應的化學方程式是_____________。
②步驟 1 中,加入過量甲醇的目的是_____________。
③步驟 3 中 Na2CO3 溶液洗滌主要去除的物質是______。該步驟中不用等量等濃度的NaOH 溶液代替Na2CO3 溶液洗滌主要原因是___________。
查看答案和解析>>
科目: 來源: 題型:
【題目】氯化亞銅是有機合成工業中應用較廣的催化劑。
(1)CuCl用作制備碳酸二甲酯的催化劑:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,請填寫化學方程式將催化原理補充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
2(CH3O)2CO+2H2O,請填寫化學方程式將催化原理補充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
(2)一種用廢銅制備氯化亞銅的過程如下:
Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ·mol-1
CuCl2(s) +Cu(s) +4HCl(aq)=2H2[CuCl3] (aq) △H=+b kJ·mol-1
CuCl(s) + 2HCl(aq)H2[CuCl3] (aq) △H=-c kJ·mol-1
①反應 2Cu(s)+Cl2(g)=2CuCl(s) △H=_______________ kJ·mol-1(用含 a、b、c 的式子表示)
②向CuCl2 溶液中加入過量銅粉,發生反應生成CuC1。但在實驗過程中要加入濃鹽酸反應才能持續進行,反應結束后將溶液倒入蒸餾水中稀釋獲得CuCl。加入濃鹽酸的目的是___________________。
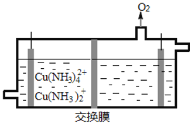
(3)在電解槽中電解氨性含銅蝕刻廢液,電解后向陰極液中加入鹽酸酸化,再倒入蒸餾水稀釋,得到氯化亞銅沉淀。
①電解裝置如圖所示,陰極區電極方程式為___________________________ 。
②稀釋過程中溶液的溫度不同,得到沉淀質量和氯化亞銅百分含量變化如圖所示。
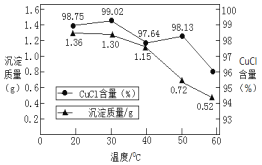
從氯化亞銅產率角度分析,最佳稀釋溫度為__________________;溫度越高得到氯化亞銅沉淀質量越小,其原因可能是:i.加熱過程中部分氯化亞銅被氧化;ii.___________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室常用王水(濃硝酸和濃鹽酸按體積比1:3的混合物)來溶解白金等貴金屬進行科學實驗。王教授用質量分數為63%的濃硝酸(密度1.40g/ ![]() )和質量分數為36.5%的濃鹽酸(密度1.19g/
)和質量分數為36.5%的濃鹽酸(密度1.19g/ ![]() )來配制王水600毫升,假設忽略兩種酸混合時的體積變化也不考慮混合后的化學變化,下列說法錯誤的是
)來配制王水600毫升,假設忽略兩種酸混合時的體積變化也不考慮混合后的化學變化,下列說法錯誤的是
A. 該王水中硝酸的物質的量濃度是3.5mol/L
B. 該王水中氧元素的質量是100.8g
C. 該王水的密度約為1.24g/ ![]()
D. 該王水中HCl的質量分數約為26.2%
查看答案和解析>>
科目: 來源: 題型:
【題目】已知NA是阿伏加德羅常數的值,下列說法錯誤的是
A.3g 3He含有的中子數為1NA
B.0.1 mol·L1碳酸鈉溶液含有的CO32—數目為0.1NA
C.25℃,1.01×105Pa時,22.4LCO2中含有的氧原子數目小于2NA
D.a g正丁烷和b g異丁烷的混合物中共價鍵數目為13(a+b)NA/58
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com