
【題目】某化學小組同學探究在實驗室中![]() 檢驗的干擾因素。
檢驗的干擾因素。
(1)檢驗溶液中是否含有![]() 時先用過量鹽酸將溶液酸化,其目的是排除_______________、
時先用過量鹽酸將溶液酸化,其目的是排除_______________、![]() 、Ag+等離子可能造成的干擾。
、Ag+等離子可能造成的干擾。
(2)為了驗證鹽酸能否排除![]() 的干擾,該小組同學進行了如下實驗:
的干擾,該小組同學進行了如下實驗:
Ⅰ.量取一定體積的濃鹽酸(盛放濃鹽酸試劑瓶的標簽中部分信息如下圖),稀釋,配制成 5 mol/L 的稀鹽酸。

Ⅱ.甲同學取 0.3 g 未變質的 Na2SO3 固體,向其中加入上述 5mol/L 稀鹽酸至過量,產生大量氣泡。充分振蕩后滴加 4 滴BaCl2 溶液,迅速產生白色渾濁,產生白色渾濁的原因可能是:
①______________。
②鹽酸中含有 Fe3+,實驗證實含有 Fe3+的方案是:___________________,用離子方程式解釋由 Fe3+產生白色渾濁的原因:__________。
(3)乙同學提出,檢驗![]() 時能否用硝酸酸化來排除
時能否用硝酸酸化來排除![]() 的干擾,丙同學認為不可行,理由是(用離子方程式表示)____________________________,繼續實驗:稱取 5 份 0.3 g 未變質的Na2SO3 固體,分別向其中加入 10 mL 不同濃度的硝酸, 振蕩;再滴加 4 滴BaCl2 溶液,觀察并記錄實驗現象如下表。
的干擾,丙同學認為不可行,理由是(用離子方程式表示)____________________________,繼續實驗:稱取 5 份 0.3 g 未變質的Na2SO3 固體,分別向其中加入 10 mL 不同濃度的硝酸, 振蕩;再滴加 4 滴BaCl2 溶液,觀察并記錄實驗現象如下表。
硝酸濃度(mol/L) | 滴加氯化鋇溶液之前現象 | 滴加氯化鋇溶液之后現象 |
15.0(濃硝酸) | 產生大量紅棕色氣體,溶液呈黃色 | 立即產生大量白色沉淀 |
7.5 | 產生大量紅棕色氣體,溶液呈淡黃色 | 立即產生大量白色沉淀 |
4.8 | 產生少量無色、刺激性氣味氣體,溶液無色 | 開始無現象,約 60 min 后溶液開始變渾濁 |
2.0 | 產生少量無色、刺激性氣味氣體,溶液無色 | 開始無現象,約 70 min 后溶液開始變渾濁 |
0.5 | 產生少量無色、刺激性氣味氣體,溶液無色 | 開始無現象,約 120 min 后溶液開始變渾濁 |
依據上述實驗得出的結論是:________________。
(4)丙同學查閱資料后提出:Cl-的存在也會對![]() 的檢驗產生干擾。在 Cl-催化作用下,稀硝酸可將
的檢驗產生干擾。在 Cl-催化作用下,稀硝酸可將![]() 氧化為
氧化為 ![]() 。為證明上述觀點,設計如下實驗,請將實驗ⅱ的操作補充完整。
。為證明上述觀點,設計如下實驗,請將實驗ⅱ的操作補充完整。
實驗 | 實驗操作 | 實驗現象 |
ⅰ | 將 0.3 g Na2SO3 和 0.3 g NaCl 固體混合,加入 10 mL 2.0mol/L 的稀硝酸,振蕩后,再滴加 4 滴 BaCl2 溶液。 | 立即產生大量白色沉淀。 |
ⅱ | ____________。 | 放置兩小時后溶液未變渾濁。 |
【答案】![]() 鹽酸中殘留有游離氯(氯氣)將
鹽酸中殘留有游離氯(氯氣)將![]() 氧化成
氧化成![]() 取少量鹽酸于試管中,滴加KSCN 溶液,溶液變紅 2Fe3++
取少量鹽酸于試管中,滴加KSCN 溶液,溶液變紅 2Fe3++![]() +H2O=
+H2O=![]() +2Fe2++2H+ 、Ba2++
+2Fe2++2H+ 、Ba2++![]() =BaSO4↓ 3
=BaSO4↓ 3![]() + 2
+ 2![]() + 2H+=3
+ 2H+=3![]() + 2NO↑+ H2O 或
+ 2NO↑+ H2O 或![]() + 2
+ 2![]() + 2H+=
+ 2H+=![]() + 2NO2↑+ H2O 實驗室檢驗
+ 2NO2↑+ H2O 實驗室檢驗![]() 時,用 0.5~4.8 mol/L 的硝酸酸化,能排除
時,用 0.5~4.8 mol/L 的硝酸酸化,能排除 ![]() 的干擾 向 0.3 g Na2SO3 固體中加入 10 mL 2.0 mol/L 的稀硝酸,振蕩后,再滴加 4 滴Ba(NO3)2溶液
的干擾 向 0.3 g Na2SO3 固體中加入 10 mL 2.0 mol/L 的稀硝酸,振蕩后,再滴加 4 滴Ba(NO3)2溶液
【解析】
檢驗![]() 時,通常加入Ba2+,但同時需防止某些離子的直接干擾,如
時,通常加入Ba2+,但同時需防止某些離子的直接干擾,如![]() 、
、![]() 等;還需防止某些離子的間接干擾,如
等;還需防止某些離子的間接干擾,如![]() 、Fe3+等,那么HNO3不管濃度如何,是否都能將
、Fe3+等,那么HNO3不管濃度如何,是否都能將![]() 氧化為
氧化為![]() ,看似不相干的Cl-是否也會影響
,看似不相干的Cl-是否也會影響![]() 的檢驗,通過對實驗結果的分析,我們可得出結論。
的檢驗,通過對實驗結果的分析,我們可得出結論。
(1)檢驗![]() 時,常加入Ba2+,而溶液中既能與Ba2+反應又能與鹽酸反應的離子,會干擾
時,常加入Ba2+,而溶液中既能與Ba2+反應又能與鹽酸反應的離子,會干擾![]() 的檢驗,所以先用過量鹽酸將溶液酸化,其目的是排除
的檢驗,所以先用過量鹽酸將溶液酸化,其目的是排除![]() 、
、![]() 、Ag+等離子可能造成的干擾。答案為:
、Ag+等離子可能造成的干擾。答案為:![]() ;
;
(2) 甲同學取 0.3 g 未變質的 Na2SO3 固體,向其中加入上述 5mol/L 稀鹽酸至過量,產生大量氣泡。充分振蕩后滴加 4 滴BaCl2 溶液,迅速產生白色渾濁。
從標簽信息中可以看出,濃鹽酸中含有Cl2、Fe3+,它們都具有氧化性。所以可能原因是:
①鹽酸中殘留有游離氯(氯氣)將![]() 氧化成
氧化成![]() 。
。
②鹽酸中含有 Fe3+,可用KSCN溶液證實,從而得出證實含有 Fe3+的方案是:取少量鹽酸于試管中,滴加KSCN 溶液,溶液變紅。用離子方程式解釋由 Fe3+產生白色渾濁的原因:2Fe3++![]() +H2O=
+H2O=![]() +2Fe2++2H+ 、Ba2++
+2Fe2++2H+ 、Ba2++![]() =BaSO4↓。答案為:鹽酸中殘留有游離氯(氯氣)將
=BaSO4↓。答案為:鹽酸中殘留有游離氯(氯氣)將![]() 氧化成
氧化成![]() ;取少量鹽酸于試管中,滴加KSCN 溶液,溶液變紅;2Fe3++
;取少量鹽酸于試管中,滴加KSCN 溶液,溶液變紅;2Fe3++![]() +H2O=
+H2O=![]() +2Fe2++2H+ 、Ba2++
+2Fe2++2H+ 、Ba2++![]() =BaSO4↓;
=BaSO4↓;
(3)乙同學提出,檢驗![]() 時能否用硝酸酸化來排除
時能否用硝酸酸化來排除![]() 的干擾,丙同學認為硝酸能將
的干擾,丙同學認為硝酸能將![]() 氧化,所以不可行,理由是3
氧化,所以不可行,理由是3![]() + 2
+ 2![]() + 2H+=3
+ 2H+=3![]() + 2NO↑+ H2O 或
+ 2NO↑+ H2O 或![]() + 2
+ 2![]() + 2H+=
+ 2H+=![]() + 2NO2↑+ H2O;繼續實驗:從表中數據及現象可以看出,當硝酸的濃度大于4.8mol/L時,能將
+ 2NO2↑+ H2O;繼續實驗:從表中數據及現象可以看出,當硝酸的濃度大于4.8mol/L時,能將![]() 迅速氧化,當硝酸的濃度小于4.8mol/L時,很難將
迅速氧化,當硝酸的濃度小于4.8mol/L時,很難將![]() 氧化,依據實驗得出的結論是:實驗室檢驗
氧化,依據實驗得出的結論是:實驗室檢驗![]() 時,用 0.5~4.8 mol/L 的硝酸酸化,能排除
時,用 0.5~4.8 mol/L 的硝酸酸化,能排除 ![]() 的干擾。答案為:3
的干擾。答案為:3![]() + 2
+ 2![]() + 2H+=3
+ 2H+=3![]() + 2NO↑+ H2O 或
+ 2NO↑+ H2O 或![]() + 2
+ 2![]() + 2H+=
+ 2H+=![]() + 2NO2↑+ H2O;實驗室檢驗
+ 2NO2↑+ H2O;實驗室檢驗![]() 時,用 0.5~4.8 mol/L 的硝酸酸化,能排除
時,用 0.5~4.8 mol/L 的硝酸酸化,能排除 ![]() 的干擾;
的干擾;
(4)丙同學查閱資料后提出:Cl-的存在也會對![]() 的檢驗產生干擾。在 Cl-催化作用下,稀硝酸可將
的檢驗產生干擾。在 Cl-催化作用下,稀硝酸可將![]() 氧化為
氧化為![]() 。為證明上述觀點,可設計兩個對比實驗,一個含有Cl-,一個不含有Cl-,從而得出實驗ⅱ的操作為:向 0.3 g Na2SO3 固體中加入 10 mL 2.0 mol/L 的稀硝酸,振蕩后,再滴加 4 滴Ba(NO3)2溶液。答案為:向 0.3 g Na2SO3 固體中加入 10 mL 2.0 mol/L 的稀硝酸,振蕩后,再滴加 4 滴Ba(NO3)2溶液。
。為證明上述觀點,可設計兩個對比實驗,一個含有Cl-,一個不含有Cl-,從而得出實驗ⅱ的操作為:向 0.3 g Na2SO3 固體中加入 10 mL 2.0 mol/L 的稀硝酸,振蕩后,再滴加 4 滴Ba(NO3)2溶液。答案為:向 0.3 g Na2SO3 固體中加入 10 mL 2.0 mol/L 的稀硝酸,振蕩后,再滴加 4 滴Ba(NO3)2溶液。


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:
【題目】在下圖所示的裝置中進行中和反應。通過測定反應過程中放出的熱量可測定中和熱。下列關于該實驗的說法正確的是
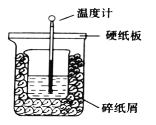
A.從實驗裝置看(量筒未畫出),圖中還缺少一個重要的儀器
B.做完一次完整的中和熱測定實驗,溫度計需要使用2次
C.燒杯間的碎紙屑的作用是固定燒杯的位置
D.由于實驗過程中有熱量的散失,所以測得的中和熱△H比理論值要小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】石油裂化和裂解過程得到的CH2=CH2,在一定條件下可以聚合成高分子化合物。含有![]() 結構的化合物與CH2=CH2一樣,可在一定條件下聚合成高分子化合物。
結構的化合物與CH2=CH2一樣,可在一定條件下聚合成高分子化合物。
(1)廣泛用作農用薄膜的聚氯乙烯塑料,是由![]() 聚合成的,其化學方程式是____________。
聚合成的,其化學方程式是____________。
(2)電器包裝中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(寫結構簡式)聚合而成的。
),它是由________________(寫結構簡式)聚合而成的。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁熱反應不僅用于焊接鋼軌,而且還常用于冶煉熔點較高的金屬如釩、鉻、錳等。
請配平下列用鋁熱反應冶煉金屬釩和鈷的化學方程式,指出哪些物質是還原劑、哪些物質是氧化劑,并計算生成1 mol各種金屬分別需要純鋁的質量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化學 來源: 題型:
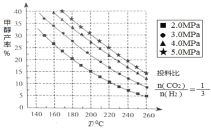
【題目】甲醇是種非常重要的化工原料,工業上CO2 用于生產燃料甲醇,既能緩解溫室效應,也為甲醇的合成尋找了新渠道。
(1)甲醇的合成:合成甲醇的反應為:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H ;在催化劑作用下,測得甲醇的產率與反應溫度、壓強關系如下圖所示, 由圖中數據可知,△H______0(選 填“>”“<”“=”),甲醇產率隨著壓強變化呈現圖示規律的原因是_______。
(2)甲醇的應用:丙炔酸甲酯是一種重要的有機化工原料,不溶于水,常溫呈液態,沸點為 103~105 ℃。實驗室可用甲醇和另一有機原料 M 在一定條件下制備,實驗步驟如下:
步驟 1:在反應瓶中,加入 13 g 原料 M、50 mL 甲醇和 2 mL 濃硫酸,攪拌,加熱回流一段時間。
步驟 2:蒸出過量的甲醇(裝置見下圖)。
步驟 3:反應液冷卻后,依次用飽和 NaCl 溶液、 5%Na2CO3 溶液、水洗滌;分離出有機相。
步驟 4:有機相經無水 Na2SO4 干燥、過濾、蒸餾, 得丙炔酸甲酯。

①步驟 1 中反應的化學方程式是_____________。
②步驟 1 中,加入過量甲醇的目的是_____________。
③步驟 3 中 Na2CO3 溶液洗滌主要去除的物質是______。該步驟中不用等量等濃度的NaOH 溶液代替Na2CO3 溶液洗滌主要原因是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室模擬氨催化氧化法制硝酸的裝置如圖所示。下列說法錯誤的是
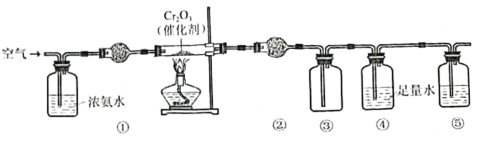
A.裝置①、②、⑤依次盛裝堿石灰、P2O5、NaOH溶液
B.裝置③中產生紅棕色氣體
C.裝置④中溶液可使紫色石蕊溶液變紅,說明有HNO3生成
D.通空氣的主要作用是鼓出氨氣,空氣可用N2代替
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示(B中冷卻裝置未畫出),將氯氣和空氣(不參與反應)以體積比約1:3混合通入含水8%的碳酸鈉中制備Cl2O,并用水吸收Cl2O制備次氯酸溶液。
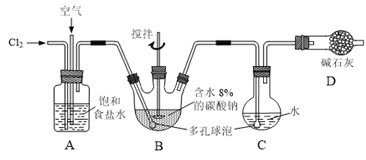
已知:Cl2O極易溶于水并與水反應生成HClO;Cl2O的沸點為3.8℃,42℃以上分解為Cl2和O2。
(1)①實驗中控制氯氣與空氣體積比的方法是______。
②為使反應充分進行,實驗中采取的措施有______。
(2)①寫出裝置B中產生Cl2O的化學方程式并用單線橋法標出電子轉移的方向和數目:______。
②若B無冷卻裝置,則進入C中的Cl2O會大量減少。其原因是______。
(3)裝置C中采用棕色圓底燒瓶是因為______。
(4)已知次氯酸可被H2O2、FeCl2等物質還原成Cl-。測定C中次氯酸溶液的物質的量濃度的實驗方案為:用酸式滴定管準確量取20.00 mL次氯酸溶液,______。(可選用的試劑:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用儀器外須使用的儀器有:電子天平,真空干燥箱)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】初始溫度為t ℃,向三個密閉的容器中按不同方式投入反應物,發生如下反應:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,測得反應的相關數據如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,測得反應的相關數據如下:
容器 | 容器類型 | 初始體積 | 初始壓強/Pa | 反應物投入量/mol | 平衡時Cl2的物質的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒溫恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 絕熱恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒溫恒壓 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列說法正確的是( )
A.反應4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,則反應向逆反應方向進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值.下列說法正確的是( )
A. 高溫下,0.2 mol Fe與足量水蒸氣反應,生成的H2分子數目為0.3NA
B. 室溫下,1 L pH=13的NaOH溶液中,由水電離的OH﹣離子數目為0.1NA
C. 氫氧燃料電池正極消耗22.4 L(標準狀況)氣體時,電路中通過的電子數目為2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反應中,生成28 g N2時,轉移的電子數目為3.75NA
2HNO3+4N2↑+9H2O反應中,生成28 g N2時,轉移的電子數目為3.75NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com