
科目: 來源: 題型:
【題目】氟他胺G是一種可用于治療腫瘤的藥物。實驗室由芳香烴A制備G的合成路線如圖:

請回答下列問題:
(1)A的化學名稱為__;C中官能團的名稱是___。
(2)③的反應試劑和反應條件分別是__,該反應類型是__。
(3)T(C7H7NO2)是E在堿性條件下的水解產物的酸化產物,同時符合下列條件的T的同分異構體有__種。其中核磁共振氫譜上有4組峰且峰面積比為1:2:2:2的物質的結構簡式為__。
①—NH2直接連在苯環上②能與新制氫氧化銅懸濁液共熱產生紅色固體
(4)參照上述合成路線,以CH3CH2COCl和![]() 為原料,經三步合成某化工產品
為原料,經三步合成某化工產品![]() 的路線為__(其他無機試劑任)。
的路線為__(其他無機試劑任)。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列圖像分別表示有關反應的反應過程與能量變化的關系,據此判斷下列說法正確的是 ( )
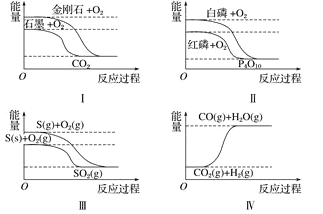
A.金剛石比石墨穩定
B.紅磷轉變為白磷是吸熱反應
C.S(g)+O2(g) === SO2(g) ΔH1 ;S(s)+O2(g) === SO2(g) ΔH2,則ΔH1>ΔH2
D.CO(g)+H2O(g) === CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:H2(g)+![]() O2(g) === H2O(l) ΔH=—285.8 kJ/mol
O2(g) === H2O(l) ΔH=—285.8 kJ/mol
CH4(g)+2O2(g) === CO2(g)+2H2O(l) ΔH=—890 kJ/mol.
現有H2與CH4的混合氣體112 L(標準狀況),使其完全燃燒生成CO2和H2O(l),若實驗測得反應放熱2 938.75 kJ。原混合氣體中H2與CH4的質量之比大約是 ( )
A.1∶1B.1∶8C.1∶4D.1∶16
查看答案和解析>>
科目: 來源: 題型:
【題目】在四個不同的容器中,在不同的條件下進行合成氨的反應,根據下列在相同時間內測定的結果判斷,化學反應速率最快的是 ( )
A.v(H2)=0.2 mol·L-1·min-1B.v(H2)=0.04 mol·L-1·s-1
C.v(N2)=0.01 mol·L-1·s-1D.v(N2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目: 來源: 題型:
【題目】在36 g碳不完全燃燒所得氣體中,CO占![]() 體積,CO2占
體積,CO2占![]() 體積,且C(s)+
體積,且C(s)+![]() O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+
O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+![]() O2(g) = CO2(g) ΔH=—283 kJ/mol。與這些碳完全燃燒相比,損失的熱量是 ( )
O2(g) = CO2(g) ΔH=—283 kJ/mol。與這些碳完全燃燒相比,損失的熱量是 ( )
A.172.5 kJB.110.5 kJC.283 kJD.566 kJ
查看答案和解析>>
科目: 來源: 題型:
【題目】ClO2是一種殺菌消毒效率高、二次污染小的水處理劑,實驗室中可通過以下反應制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O據此,下列說法不正確的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O據此,下列說法不正確的是( )
A. KClO3發生還原反應
B. H2C2O4在反應中被氧化
C. H2C2O4的氧化性強于C1O2的氧化性
D. 每1mol C1O2生成,該反應轉移的電子數約為6.02×1023
查看答案和解析>>
科目: 來源: 題型:
【題目】鐵系元素是人體必需的微量元素, Fe3+可以與KSCN溶液、苯酚等發生顯色作用。鎂元素也是人體所必需的陽離子元素之一,它能夠維持核酸結構的穩定性,調節機體免疫功能,對人體抵抗新冠病毒等病毒侵襲起著重要作用。
(1)Fe3+的基態核外電子排布式為____________________。
(2)與SCN互為等電子體且為非極性分子的化學式為__________(任寫一種)。
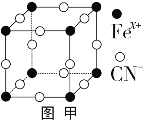
(3)普魯士藍俗稱鐵藍,晶胞如圖甲所示(K+未畫出),平均每兩個晶胞立方體中含有一個K+,又知該晶體中鐵元素有+2價和+3價兩種,則Fe3+與Fe2+的個數比為_________。
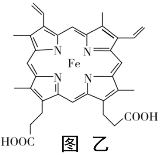
(4)血紅素鐵(圖乙)用作鐵強化劑,其吸收率比一般鐵劑高3倍,在圖乙中畫出Fe2+與N原子間的化學鍵(若是配位鍵,需要用箭頭加以表示)______________
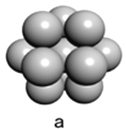
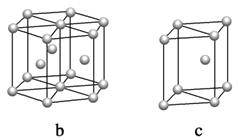
(5)鎂單質晶體中原子的堆積模型如圖,它的堆積模型名稱為____________;晶胞是圖中的_________________(填a、b或c);配位數是__________________;緊鄰的四個鎂原子的中心連線構成的正四面體幾何體的體積是2a cm3,鎂單質的密度為ρ g·cm-3,已知阿伏伏德羅常數為NA,則鎂的摩爾質量的計算式是________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】碳及其化合物在工農業生產和日常生活中有廣泛的應用,對其研究具有重要意義。
回答下列問題:
(1)利用活性炭的___作用可去除水中的懸浮雜質。
(2)炭黑可以活化氧分子得到活化氧(O*),活化氧可以快速將SO2氧化為SO3,其活化過程中的能量變化如圖所示:
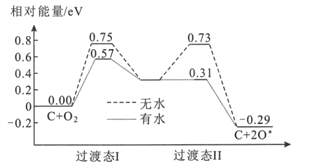
活化過程中有水時的活化能降低了___eV。在酸雨的形成過程中,炭黑起:___作用。
(3)已知:CO(g)+2H2(g)![]() CH3OH(g) H,經測定不同溫度下該反應的濃度平衡常數如下:
CH3OH(g) H,經測定不同溫度下該反應的濃度平衡常數如下:

①該反應的△H___0(填“>”或“<");250℃時,某時刻測得反應體系中c(CO)=0.4mol·L-1、c(H2)=0.4mol·L-1、c(CH3OH)=0.8mol·L-1,則此時v正__v逆(填“>”、“=”或“<”)。.
②某溫度下,在2L剛性容器中,充入0.8molCO和1.6molH2,壓強為p,tmin后達到平衡,測得壓強為![]() P。則v(H2)=____mol·L-1·min-1,平衡時的Kp=____。
P。則v(H2)=____mol·L-1·min-1,平衡時的Kp=____。
(4)科研人員設計了甲烷燃料電池電解飽和食鹽水裝置如圖所示,電池的電解質是摻雜了Y2O3與ZrO2的固體,可在高溫下傳導O2-。
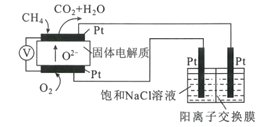
①該電池工作時負極反應方程式為____。
②用該電池電解100mL飽和食鹽水,若在兩極產生的氣體體積分別為V1L、V2L(標準狀況),且V1>V2,則電解所得溶液的c(OH-)=____mol·L-1(忽略氣體溶解和溶液體積變化)。
查看答案和解析>>
科目: 來源: 題型:
【題目】某科研小組利用電導率(電導率越大,導電能力越強)傳感器、pH傳感器探究NaHCO3和CaCl2能否發生化學反應。向25.00mL0.1mol·L-1NaHCO3溶液中滴入等體積、等濃度CaCl2溶液,電導率以及pH變化曲線如圖所示。下列說法錯誤的是( )
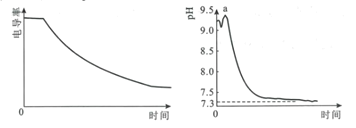
A.電導率下降的原因是生成了CaCO3沉淀導致溶液中離子濃度降低
B.a點后pH下降的原因是Ca2+促進HCO3![]() H++CO
H++CO![]() 平衡右移
平衡右移
C.pH=7.3時,溶液中溶質主要為NaCl、CaCl2
D.可用0.1mol·L-1CaCl2溶液鑒別濃度均為0.1mol·L-1的NaHCO3和Na2CO3溶液
查看答案和解析>>
科目: 來源: 題型:
【題目】MOF衍生碳納米棒封裝的氧化鉍催化劑對CO2電化學法制取HCOOH具有快速高效的選擇性。其原理圖如圖,下列有關說法正確的是

A.該方法可有效消除CO2對大氣造成的污染
B.該電極應與電源的正極相連
C.該電極反應式為:CO2-2e-+2H+=HCOOH
D.選擇使用其他催化劑可能得到HCHO或CH3OH等產物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com