
科目: 來源: 題型:
【題目】“新冠病毒”疫情讓人們再次認識到化學的重要性。下列有關抗疫物資的化學用語表示正確的是( )
A.中子數為127的碘原子:![]()
B.供氧劑中過氧化鈣(CaO2)的電子式:![]()
C.84消毒液中次氯酸鈉的電離方程式:NaClO![]() Na++ClO-
Na++ClO-
D.口罩“熔噴層”原料中聚丙烯的結構簡式:![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】次硫酸氫鈉甲醛(aNaHSO2bHCHOcH2O)在印染、醫藥以及原子能工業中應用廣泛。以Na2SO3、SO2、HCHO和鋅粉為原料制備次硫酸氫鈉甲醛的實驗步驟如下:

步驟1:在如圖所示裝置的燒瓶中加入一定量Na2SO3和水,攪拌溶解,緩慢通入SO2,至溶液pH約為4,制得NaHSO3溶液。
步驟2:將裝置A中導氣管換成橡皮塞。向燒瓶中加入稍過量的鋅粉和一定量甲醛溶液,在80~90℃下,反應約3h,冷卻至室溫,抽濾。
步驟3:將濾液真空蒸發濃縮,冷卻結晶。
(1)裝置B的燒杯中應加入的溶液是___。
(2)步驟2中加入鋅粉時有NaHSO2和Zn(OH)2生成。
①寫出加入鋅粉時發生反應的化學方程式:___。
②生成的Zn(OH)2會覆蓋在鋅粉表面阻止反應進行,防止該現象發生的措施是___。
(3)冷凝管中回流的主要物質除H2O外,還有___(填化學式)。
(4)步驟3中次硫酸氫鈉甲醛不在敞口容器中蒸發濃縮的原因是___。
(5)步驟2抽濾所得濾渣的成分為Zn和Zn(OH)2,利用濾渣制備ZnO的實驗步驟為:將濾渣置于燒杯中,___,900℃煅燒。(已知:Zn與鋁類似,能與NaOH溶液反應;Zn2+開始沉淀的pH為5.9,沉淀完全的pH為8.9,pH>11時,Zn(OH)2能生成ZnO22-。實驗中須使用的試劑有1.0molL-1NaOH溶液、1.0molL-1HCl溶液、水)
(6)產物組成測定實驗:
準確稱取1.5400g樣品,溶于水配成l00mL溶液;取25.00mL樣品溶液經AHMT分光光度法測得溶液吸光度A=0.4000(如圖);另取25.00mL樣品溶液,加入過量碘水后,加入BaCl2溶液至沉淀完全,過濾、洗滌、干燥至恒重得到BaSO4固體0.5825g。
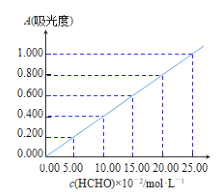
①樣品溶液HCHO濃度為___molL-1。
②通過計算確定aNaHSO2·bHCHOcH2O的化學式為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】一種固定煙氣中CO2的工藝流程如下:
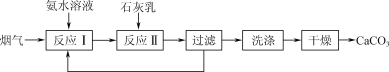
(1) “反應Ⅰ”中,CO2與過量氨水反應的離子方程式為________。
(2) “反應Ⅰ”中,提高煙氣中CO2去除率的可行措施有________(填字母)。
a. 采用高溫 b. 加快煙氣流速 c. 增大氨水濃度
(3) 若測得濾液中c(CO32-)=10-2 mol·L-1,則Ca2+是否沉淀完全?________(填“是”或“否”)。[c(Ca2+)<10-5 mol·L-1時視為沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4) “反應Ⅱ”中,溶液的pH和導電能力變化如圖1所示,導電能力初始時快速降低,后來逐漸上升的原因是____________________________________________。
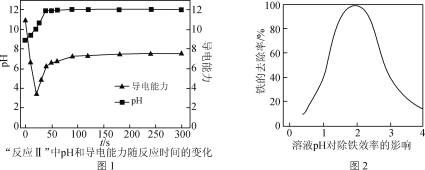
(5) CaCO3可用于調節廢水的pH,以除去其中的Fe3+。溶液pH對除鐵效率影響如圖2所示。
①除鐵時應控制溶液的pH為________(填字母)。
a. 0.5~1.5 b. 1.5~2.5 c. 2.5~3.5
② 除鐵時pH稍大會生成Fe(OH)3膠體,顯著降低除鐵效率,其原因是________。
查看答案和解析>>
科目: 來源: 題型:
【題目】一定條件下,可逆反應C(s) + CO2(g)![]() 2CO(g) △H>0,達到平衡狀態,進行如下操作:
2CO(g) △H>0,達到平衡狀態,進行如下操作:
①升高反應體系的溫度; ②增加反應物C的用量;
③縮小反應體系的體積; ④減少體系中CO的量。
上述措施中一定能使反應的正反應速率顯著加快的是
A.①②③④B.①③C.①②D.①③④
查看答案和解析>>
科目: 來源: 題型:
【題目】莫沙朵林是一種鎮痛藥,它的合成路線如下:
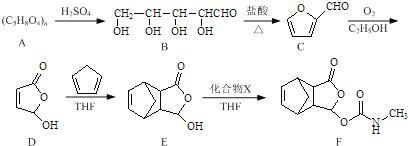
(1)B中手性碳原子數為____________;化合物D中含氧官能團的名稱為____________。
(2)C與新制氫氧化銅反應的化學方程式為____________。
(3)寫出同時滿足下列條件的E的一種同分異構體的結構簡式:____________
I.核磁共振氫譜有4個峰;
Ⅱ.能發生銀鏡反應和水解反應;
Ⅲ.能與FeCl3溶液發生顯色反應.
(4)已知E+X→F為加成反應,化合物X的結構簡式為____________。
(5)已知:![]() .化合物
.化合物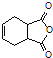 是合成抗病毒藥阿昔洛韋的中間體,請設計合理方案以
是合成抗病毒藥阿昔洛韋的中間體,請設計合理方案以![]() 和
和![]() 為原料合成該化合物(用合成路線流程圖表示,并注明反應條件).______________。
為原料合成該化合物(用合成路線流程圖表示,并注明反應條件).______________。
合成路線流程圖示例如下:![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】2019年10月1曰,在慶祝中華人民共和國成立70周年的閱兵儀式上,最后亮相的DF-31A洲際戰略導彈是我國大國地位、國防實力的顯著標志。其制作材料中包含了Fe、Cr、Ni、C等多種元素。回答下列問題:
(1)基態Cr原子的價電子排布式為___。
(2)實驗室常用KSCN溶液、苯酚(![]() )檢驗Fe3+。
)檢驗Fe3+。
①第一電離能:N___O(填“>”或“<”)。
②1mol苯酚中含有的σ數目為___。
③苯酚中的氧原子和碳原子均采用相同的雜化方式,其類型為___。
④從結構的角度分析苯酚的酚羥基有弱酸性的原因為___。
(3)碳的一種同素異形體的晶體可采取非最密堆積,然后在空隙中插入金屬離子獲得超導體。如圖為一種超導體的面心立方晶胞,C60分子占據頂點和面心處,K+占據的是C60分子圍成的___空隙和___空隙(填幾何空間構型);若C60分子的坐標參數分別為A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,則距離A位置最近的陽離子的原子坐標參數為___。
),C(1,1,1)等,則距離A位置最近的陽離子的原子坐標參數為___。
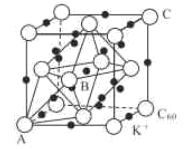
(4)Ni可以形成多種氧化物,其中一種NiaO晶體晶胞結構為NaCl型,由于晶體缺陷,a的值為0.88,且晶體中的Ni分別為Ni2+、Ni3+,則晶體Ni2與Ni3+產的最簡整數比為___,晶胞參數為428pm,則晶體密度為___gcm-3(NA表示阿伏加德羅常數的值,列出表達式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】可逆反應2A+3B![]() 2C+D,(A、B、C、D都為氣體)在四種不同條件下的反應速率分別如下,則該反應在不同條件下反應速率最快的是( )
2C+D,(A、B、C、D都為氣體)在四種不同條件下的反應速率分別如下,則該反應在不同條件下反應速率最快的是( )
A.v(A)=0.5mol/ (L·min)B.v(B)=0.6mol/ (L·min)
C.v(C)=0.35mol/ (L·min)D.v(D)=0.4mol/ (L·min)
查看答案和解析>>
科目: 來源: 題型:
【題目】鐵是應用最廣泛的金屬,自遠古時代人類就學會了煉鐵,到目前為止,人類研制出了很多煉鐵的方法。某研究性學習小組同學在實驗室中模擬工業煉鐵的過程,實驗裝置如下:

(1)寫出得到單質鐵的化學方程式:_________________________。
(2)實驗過程中看到玻璃管內的粉末由紅棕色逐漸變黑,請設計一個實驗來驗證生成了單質鐵:______。
(3)裝置末端氣球的作用為_____________________________。實驗結束時,應該先停止加熱還是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】乙烯、環氧乙院是重要的化工原料,用途廣泛。回答下列問題:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6kJmo1-1
(g) △H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反應III:△S(填“>”“<”或“=”)___0。
(2)熱值是表示單位質量的燃料完全燃燒時所放出的熱量,是燃料質量的一種重要指標。已知乙烯的熱值為50.4kJg-1,則△H3=___kJmol-1
(3)實驗測得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆為速率常數,只與溫度有關)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆為速率常數,只與溫度有關)。
①反應達到平衡后,僅降低溫度,下列說法正確的是(________)
A.k正、k逆均增大,且k正增大的倍數更多
B.k正、k逆勻減小,且k正減小的倍數更少
C.k正增大、k逆減小,平衡正向移動
D.k正、k逆均減小,且k逆減小的倍數更少
②若在1L的密閉容器中充入1molCH2=CH2(g)和1molO2(g),在一定溫度下只發生反應I,經過10min反應達到平衡,體系的壓強變為原來的0.875倍,則0~10min內v(O2)=___,![]() =___。
=___。
(4)現代制備乙烯常用乙烷氧化裂解法:
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反應中還存在CH4、CO、CO2等副產物(副反應均為放熱反應),圖1為溫度對乙烷氧化裂解反應性能的影響。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反應中還存在CH4、CO、CO2等副產物(副反應均為放熱反應),圖1為溫度對乙烷氧化裂解反應性能的影響。
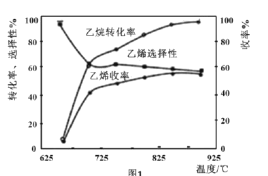
①乙烷的轉化率隨溫度的升高而升高的原因是___;反應的最佳溫度為___(填序號)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯選擇性=![]() ;乙烯收率=乙烷轉化率×乙烯選擇性]
;乙烯收率=乙烷轉化率×乙烯選擇性]
②工業上,保持體系總壓恒定為l00kPa的條件下進行該反應,通常在乙烷和氧氣的混合氣體中摻混惰性氣體(惰性氣體的體積分數為70%),摻混惰性氣體的目的是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com