
科目: 來源: 題型:
【題目】mA(g)+nB(g)![]() pC(g)△H<0,室溫條件下,在一容積不變的密閉容器中加入一定量的A、B,B%與壓強(P)的關系如圖所示,則下列有關敘述正確的是( )
pC(g)△H<0,室溫條件下,在一容積不變的密閉容器中加入一定量的A、B,B%與壓強(P)的關系如圖所示,則下列有關敘述正確的是( )
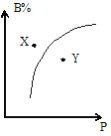
A.m+n>p
B.n>p
C.X點時混合物的正反應速率小于逆反應速率
D.X點比Y點混合物的反應速率慢
查看答案和解析>>
科目: 來源: 題型:
【題目】Zn3(PO4)2·2H2O(溶于酸,難溶于水)是一種無毒害作用的防銹顏料,利用鋅浮渣(主要含Zn、ZnO、ZnCl2,還含少量的鐵、錳、銅、鉛及砷的化合物等)制取Zn3(PO4)2·2H2O的工藝流程如圖:
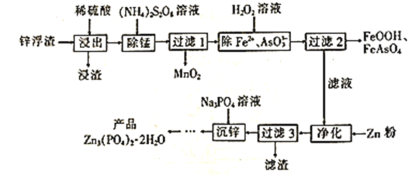
回答下列問題:
(1)“浸出”時,下列措施能提高鋅的浸取率的是__(填字母)。
A.用濃硫酸代替稀硫酸 B.適當升高浸取液的溫度
C.將“浸渣”再次浸取 D.縮短“浸出”時間
(2)“除錳”時,Mn2+發生反應的離子方程式為__(S2O![]() 被還原為SO
被還原為SO![]() )。
)。
(3)流程中除鐵、砷時,當生成8.9gFeOOH和7.8gFeAsO4時,消耗H2O2__mol。
(4)“凈化”時加鋅粉的目的是__。
(5)“沉鋅”時發生反應的化學方程式為__。
(6)“沉鋅”至得到“產品”還需要經過的操作是__、洗滌、__。證明產品已洗滌干凈的實驗方法是__。
(7)Meyer等認為磷酸鋅防腐機理是在鋼鐵表面形成組成近似為Zn2Fe(PO4)2·4H2O的覆蓋膜,則在形成該覆蓋膜的過程中,負極的電極反應式為__。
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組同學欲探究NH3的催化氧化反應,按如圖裝置進行實驗。A、B裝置可選用的藥品:濃氨水、H2O2溶液、蒸餾水、NaOH固體、MnO2。

(1)NH3催化氧化的化學方程式是____。
(2)甲、乙兩同學分別按如圖裝置進行實驗。一段時間后,裝置G中的溶液都變成藍色。
①甲觀察到裝置F中有紅棕色氣體,生成紅棕色氣體的化學方程式是___。
②乙觀察到裝置F中只有白煙生成,白煙的成分是___(填化學式)。
③用離子方程式解釋裝置G中溶液變成藍色的原因:___。
(3)為幫助乙實現在裝置F中也觀察到紅棕色氣體,如何改進___。
(4)為實現該反應,也可用如圖所示的裝置替換原裝置中虛線框部分。
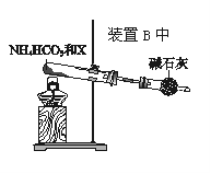
化合物X為__;NH4HCO3的作用是__。
查看答案和解析>>
科目: 來源: 題型:
【題目】從下列實驗事實所得出的相應結論不正確的是( )
選項 | 實驗事實 | 結論 |
A | 其他條件不變,0.01mol·L-1的酸性KMnO4溶液分別與0.1mol·L-1的H2C2O4溶液和0.2mol·L-1的H2C2O4溶液反應,后者退色時間短 | 當其他條件不變時,增大反應物濃度可以使化學反應速率加快 |
B | 其他條件不變,分別將等體積、等物質的量濃度的Na2S2O3溶液和硫酸溶液的混合液放在冷水和熱水中,放在熱水中的混合液先出現渾濁 | 當其他條件不變時,反應體系的溫度越高,化學反應速率越快 |
C | 一定條件下,分別在容積為1L和容積為2L的兩個密閉容器中加入等量的氫氣和碘蒸氣,相同溫度下發生如下反應:H2(g)+I2(g) | 當其他條件不變時,純氣態反應體系的壓強越大,化學反應速率越快 |
D | 將少量MnO2粉末加入盛有10%H2O2溶液的錐形瓶內,在化學反應前后,MnO2的質量和化學性質都沒有發生變化 | 催化劑雖然可以加快化學反應的速率,但一定不參與化學反應 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 來源: 題型:
【題目】某溶液可能含有Na+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干種。為了確定該溶液的組成,進行如下實驗:
①取100 mL上述溶液,加入足量氯化鋇溶液,充分反應后將沉淀過濾、洗滌、干燥,得到4.30 g固體。向該固體中加過量的稀硝酸,仍有2.33 g固體未溶解。
②向①的濾液中加入足量NaOH,加熱,產生使濕潤的紅色石蕊試紙變藍的氣體0.448 L(氣體全部逸出,且已經換算成標準狀況下體積)。以下說法正確的是
A.原溶液中SO42–、CO32–和NH4+一定存在,Cl-一定不存在
B.原溶液中一定不存在Ca2+,無法判斷Na+是否存在
C.原溶液中可能存在Cl-,且c(Na+) ≥ 0.200 mol· L-1
D.為確定原溶液中Cl-是否存在,可以取實驗①的濾液,加硝酸酸化的AgNO3進行檢驗
查看答案和解析>>
科目: 來源: 題型:
【題目】某研究小組以苯乙烯和乙烯為主要原料,設計出醫藥中間體G的合成路線如圖:

已知RCOOH![]() RCOCl
RCOCl![]() RCOOR’。
RCOOR’。
(1)B中含氧官能團的名稱為___;D的結構簡式為___。
(2)乙烯的某種同系物的化學名稱為“甲基丙烯”,則甲基丙烯的結構簡式為___。
(3)B能通過分子間脫水生成有機物X,X可用于香料,其結構中含有三個六元環狀結構,則B轉化為X的化學方程式:___。
(4)M是G的同分異構體,符合下列結構和性質的芳香族化合物M共有___種(不考慮立體異構)。
①1molM與銀氨溶液反應最多能得4molAg;
②苯環上有四個取代基,其相對位置為![]() ;
;
③核磁共振氫譜為5組峰,且峰面積為2:2:2:2:1;
④M能發生消去反應。
寫出M發生消去反應的化學方程式:___(一例即可)。
(5)設計出以甲苯為原料制備B的合成路線(無機試劑任選,已知:RCHO![]()
![]() ,RCN
,RCN![]() RCOOH)___。
RCOOH)___。
合成路線常用的表示方式為:A![]() B……
B……![]() 目標產物。
目標產物。
查看答案和解析>>
科目: 來源: 題型:
【題目】碳是形成單質和化合物最多的元素,其單質及化合物有獨特的性質和用途。請回答下列問題。
(1)C原子的價電子軌道表達式為__。
(2)碳可以形成多種有機化合物,如圖所示是一種嘌呤和一種吡啶的結構,兩種分子中所有原子都在一個平面上。
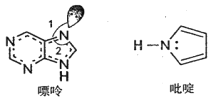
①嘌呤中所有元素的電負性由大到小的順序__。
②吡啶結構中N原子的雜化方式是___。
③NH3的鍵角__PH3的鍵角,理由是__。
④分子中的大π鍵可以用符號π![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數。嘌呤和吡啶中都含有大π鍵,請問該吡啶中的大π鍵表示為__。
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數。嘌呤和吡啶中都含有大π鍵,請問該吡啶中的大π鍵表示為__。
(3)石墨烯中部分碳原子被氧化后,轉化為氧化石墨烯。
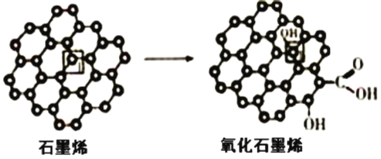
石墨烯轉化為氧化石墨烯時,1號C與相鄰C原子間鍵能的變化是__(填“變大”、“變小”“不變”)。
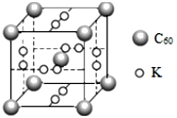
(4)石墨烯可轉化為富勒烯(C60),C60和K能形成新型化合物,其晶胞如圖所示,晶胞參數為anm該化合物中K原子和C60分子的個數比為___,該晶體的密度ρ=___g/cm3(阿伏加德羅常數為6.02×1023)。
查看答案和解析>>
科目: 來源: 題型:
【題目】現有標準狀況下四種氣體①8.96L![]() ; ②
; ②![]() 個
個![]() ; ③30.6g
; ③30.6g![]() ; ④
; ④![]() 。下列關系從小到大表示不正確的是( )
。下列關系從小到大表示不正確的是( )
A.體積:④<①<②<③B.密度:①<④<③<②
C.質量:④<①<③<②D.氫原子數:②<④<①<③
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上,常采用氧化還原方法處理尾氣中的CO、NO。
(氧化處理法)瀝青混凝土可作為反應:2CO(g)+O2(g)![]() 2CO2(g)的催化劑。
2CO2(g)的催化劑。
圖甲表示在相同的恒容密閉容器、相同起始濃度、相同反應時間段下,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。
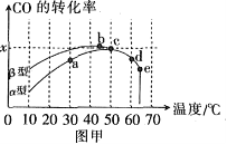
(1)在a、b、c、d四點中,未達到平衡狀態的是___。
(2)已知c點時容器中O2濃度為0.04mol·L-1,則50℃時,在α型瀝青混凝土中CO轉化反應的平衡常數K=___(用含x的代數式表示)。
(3)下列關于圖甲的說法正確的是__。
A.CO轉化反應的平衡常數K(a)<K(c)
B.在均未達到平衡狀態時,同溫下β型瀝青混凝土中CO轉化速率比α型要大
C.b點時CO與O2分子之間發生有效碰撞的幾率在整個實驗過程中最高
D.e點轉化率出現突變的原因可能是溫度升高后催化劑失去活性
(還原處理法)某含鈷催化劑可以催化消除柴油車尾氣中的碳煙(C)和NOx。不同溫度下,將模擬尾氣(含0.025molNO、0.5molO2和足量碳煙)以相同的流速通過該催化劑,測得所有產物(CO2、N2、N2O)與NO的相關數據,結果如圖乙所示。
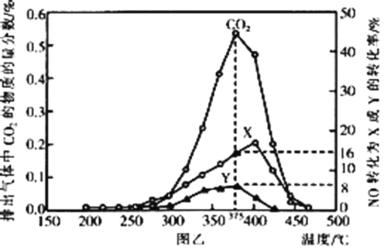
(4)375℃時,測得排出的氣體中含0.45molO2和0.052molCO2,則Y的化學式為___。
(5)實驗過程中采用NO模擬NOx,而不采用NO2的原因是___。
(6)工業上常用高濃度的K2CO3溶液吸收CO2,再利用電解法使K2CO3溶液再生,其裝置示意圖如圖:
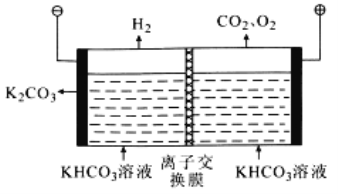
①在陽極區發生的反應包括___和H++HCO3- =CO2↑+H2O
②簡述CO32-在陰極區再生的原理:___。
查看答案和解析>>
科目: 來源: 題型:
【題目】我國有豐富的海水資源,海水資源開發和利用是化學研究的一項重要任務。如圖是某化工廠對海水資源綜合利用的示意圖,有關敘述正確的是( )
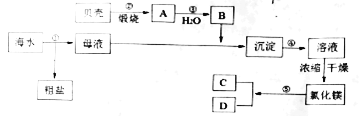
A.上述流程中步驟②~⑤涉及的化學反應包含四種基本反應類型
B.工業上冷卻電解無水氯化鎂所得的鎂蒸氣時,選擇氬氣或氮氣
C.步驟④中加入的化學試劑可以為硝酸
D.從步驟④得到的溶液中獲得的六水合氯化鎂晶體,采用蒸發結晶的方式
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com