
科目: 來源: 題型:
【題目】反應A(g)+3B(g) =2C(g)+2D(g)在四種不同情況下的反應速率分別為:①v(A)=0.45 mol·L-1·s-1、②v(B)=0.6 mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,該反應進行的快慢順序為
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
科目: 來源: 題型:
【題目】某溫度下,體積一定的密閉容器中發生如下可逆反應:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列說法正確的是
3Z(g) ΔH= QkJ/mol,下列說法正確的是
A. 消耗2 mol X同時生成3 mol Z,說明達到了平衡狀態
B. 加入少量的Y正反應速率加快
C. 氣體的密度不變時,說明達到了平衡狀態
D. 加入少量的X,Q變大
查看答案和解析>>
科目: 來源: 題型:
【題目】下圖是2SO3(g) 2SO2(g) + O2(g) 的能量變化圖,據圖得出的相關敘述正確的是
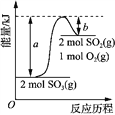
A. 2SO3(g) 2SO2(g) + O2(g) + (a-b) kJ
B. 1mol SO2的能量比1mol SO3的能量高
C. 若有2mol SO3充分反應,吸收(a-b) kJ熱量
D. 該化學反應過程中的能量變化既有吸熱又有放熱
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下,將一定量的氯氣通入100mL4mol·L-1的氫氧化鈉溶液中,發生反應的化學方程式為:Cl2+2NaOH=NaCl+NaClO+H2O。充分反應后,下列說法正確的是(NA為阿伏加德羅常數)( )
A.當通入的Cl2為2.24L時,反應中電子轉移數目為0.1NA
B.當電子轉移數目為0.2NA時,溶液質量增加14.2g
C.當溶液中Na+為0.4NA時,溶液中的Cl-為0.2NA
D.當溶液質量增加7.1g時,溶液中ClO-為0.1NA
查看答案和解析>>
科目: 來源: 題型:
【題目】現有X、Y、Z三種元素,已知有如下情況:
①X、Y、Z的單質在常溫下均為氣體。
②X的單質在Z的單質中燃燒,生成XZ,燃燒時火焰呈蒼白色。
③XZ極易溶于水,在水溶液中電離出X+和Z-。XZ的水溶液可使石蕊試液變紅。
④兩分子X的單質可與一分子Y的單質化合生成兩分子X2Y,X2Y常溫下為液體。
⑤Z的單質溶于X2Y中,所得溶液具有漂白作用。
請完成下列問題:
(1)請寫出Z-的的離子結構示意圖_____________。
(2)請寫出Z單質溶于X2Y中發生反應的離子方程式_____________。
(3)請寫出Z單質與NaOH反應的化學方程式:_____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】對于反應3Cl2+6NaOH===5NaCl+NaClO3+3H2O,以下敘述正確的是( )
A. Cl2是氧化劑,NaOH是還原劑
B. 被氧化的Cl原子和被還原的Cl原子的個數之比為5∶1
C. Cl2既是氧化劑又是還原劑
D. 每生成1個氧化產物轉移6個電子
查看答案和解析>>
科目: 來源: 題型:
【題目】在氯水中存在多種分子和離子,它們在不同的反應中表現各自的性質.下列實驗現象和結論一致且正確的是
A. 加入有色布條,一會兒有色布條褪色,說明溶液中有Cl2存在
B. 溶液呈黃綠色,且有刺激性氣味,說明有HClO分子存在
C. 加入AgNO3溶液產生白色沉淀,說明有Cl-分子存在
D. 加入NaOH溶液,氯水黃綠色消失,說明有HClO分子存在
查看答案和解析>>
科目: 來源: 題型:
【題目】固態或氣態碘分別與氫氣反應的熱化學方程式如下:
①H2(g)+I2(?)2HI(g)△H=-9.48kJmol-1
②H2(g)+I2(?)2HI(g)△H=+26.48kJmol-1
下列判斷不正確的是( )
A.![]() 中的I2為氣態,
中的I2為氣態,![]() 中的I2為固態
中的I2為固態
B.![]() 的反應物總能量比
的反應物總能量比![]() 的反應總能量低
的反應總能量低
C.1mol固態碘升華時將吸熱35.96kJ
D.反應![]() 的產物比反應
的產物比反應![]() 的產物熱穩定性更好
的產物熱穩定性更好
查看答案和解析>>
科目: 來源: 題型:
【題目】煤炭燃燒過程中會釋放出大量的SO2,嚴重破壞生態環境。采用一定的脫硫技術可以把硫元素以CaSO4的形式固定,從而降低SO2的排放。但是煤炭燃燒過程中產生的CO又會與CaSO4發生化學反應,降低脫硫效率。相關反應的熱化學方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反應I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反應I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反應II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反應II)
下列有關說法正確的是( )
A. 提高反應體系的溫度,能降低該反應體系中SO2生成量
B. 反應II在較低的溫度下可自發進行
C. 用生石灰固硫的反應為:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,則△H3>△H2
3CaSO4(s)+CaS(s) △H3,則△H3>△H2
D. 由反應I和反應II可計算出反應CaSO4(s)![]() CaO(s)+SO3(g)的焓變
CaO(s)+SO3(g)的焓變
查看答案和解析>>
科目: 來源: 題型:
【題目】將1molI2(g)和2molH2置于某2L密閉容器中,在一定溫度下發生反應:I2(g)+H2(g)![]() 2HI(g);△H<0,并達平衡,HI的體積分數ω(HI)隨時間變化如圖曲線(II)所示
2HI(g);△H<0,并達平衡,HI的體積分數ω(HI)隨時間變化如圖曲線(II)所示
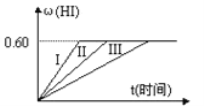
(1)達平衡時,I2(g)的物質的量濃度為____。
(2)若改變反應條件下,在甲條件下ω(HI)的變化如圖曲線(I)所示,在乙條件下ω(HI)的變化如圖曲線(III)所示。則甲條件可能是___(填入下列條件的序號。下同),乙條件可能是___。
①恒容條件下,升高溫度 ②恒容條件下,降低溫度 ③恒溫條件下,縮小反應容器體積 ④恒溫條件下,擴大反應容器體積 ⑤恒溫恒容條件下,加入適當催化劑
(3)若保持溫度不變,在另一相同的2L密閉容器中加入amolI2(g)、bmolH2和cmolHI(a、b、c均大于0),發生反應,達平衡時,HI的體積分數仍為0.60,則a、b、c的應滿足的關系是____(用含一個a、b、c的代數式表示)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com