
科目: 來源: 題型:
【題目】下列物質的轉化在給定條件下不能實現的是
A. NH3![]() NO
NO![]() HNO3
HNO3
B. 濃鹽酸![]() Cl2
Cl2![]() 漂白粉
漂白粉
C. Al2O3![]() AlCl3(aq)
AlCl3(aq)![]() 無水AlCl3
無水AlCl3
D. 葡萄糖![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO
查看答案和解析>>
科目: 來源: 題型:
【題目】把500 mL有BaCl2和KCl的混合溶液分成2等份,一份加入含a mol硫酸鈉的溶液,恰好使鋇離子完全沉淀;另一份加入含b mol硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
A.0.1(b-2a)mol/LB.0.4( 2a-b)mol/L
C.10(b-2a)mol/LD.4(b-2a)mol/L
查看答案和解析>>
科目: 來源: 題型:
【題目】設NA 表示阿伏加德羅常數的值,下列說法正確的是
A.100 mL 0.1 mol·L-1的稀硫酸中含有SO42-個數為0.1NA
B.含1 mol HCl的鹽酸與足量Fe反應,Fe所失去的電子總數為2 NA
C.4℃ 時,5.4 mL水中所含的水分子數是0.3 NA
D.標準狀況下,22.4L氫氣所含的質子數為NA
查看答案和解析>>
科目: 來源: 題型:
【題目】KCl樣品中含有少量KOH、K2SO4和不溶于水的雜質,為了提純KCl,某同學先將樣品溶于適量水中,充分攪拌后過濾,再將濾液按下圖所示步驟進行操作
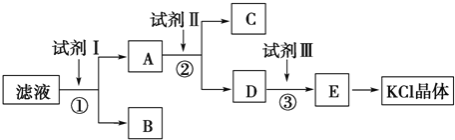
(1)試劑Ⅰ的化學式為__________,其作用是除去__________(填離子符號),
檢驗該離子完全除盡的操作是__________________________________________
(2)加入試劑Ⅱ時發生反應的化學方程式為_____________________________
(3)試劑Ⅲ的名稱是__________,各步操作中所加試劑都必須過量,欲檢驗試劑Ⅲ已經過量,可以選用__________(填字母).
A.AgNO3 B.pH試紙 C.K2CO3溶液
查看答案和解析>>
科目: 來源: 題型:
【題目】X、Y、Z、W是元素周期表中的短周期元素,它們的相對位置如下表所示,其中X、Y 元素均能形成10電子的氫化物,Z的原子序數是Y的2倍。請回答下列問題:
X | Y | |
Z | W |
(1)W的簡單離子的結構示意圖為______,Y元素在周期表中的位置是____。
(2)寫出實驗室制W元素單質的離子方程式:___________
(3)關于W同主族元素,下列說法正確的是:__________
A.從上到下密度逐漸增大
B.從上到下熔點和沸點都逐漸升高
C.從上到下元素的非金屬性越來越強
D.同主族元素對應的單質中,只有W元素對應的單質在常態下為氣態
(4)W與Z形成的液體化合物Z2W2,該物質可與水反應生成ZO2氣體,1 mol Z2W2參加反應時轉移1.5 mol電子,其中只有一種元素化合價發生改變,Z2W2與水反應的化學方程式為_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】某興趣小組制備氫氧化亞鐵沉淀。
實驗1 |
| 實驗現象 |
液面上方產生白色絮狀沉淀,迅速變為灰綠色,振蕩,試管壁上有紅褐色沉淀生成。 |
(1)實驗1中產生白色沉淀的離子方程式是_______。
(2)為了探究沉淀變灰綠色的原因,該小組同學展開如下探究:
①甲同學推測灰綠色物質為Fe(OH)2和Fe(OH)3混合物。查閱資料后根據調色原理認為白色和紅褐色的調和色不可能是灰綠色,并設計實驗證實灰綠色物質中不含有Fe(OH)3,方案是______。
②乙同學查閱文獻:Fe(OH)2在大量SO42-存在的情況下形成Fe6(SO4)2(OH)4O3(一種灰綠色氧基堿式復鹽)。并設計對比實驗證實該假設:向試管中加入________,再往試管中加入_________,振蕩,現象與實驗1相同,結論是該假設不成立。
③乙同學繼續查閱文獻:Fe(OH)2沉淀具有較強的吸附性能,灰綠色可能是由Fe(OH)2表面吸附Fe2+引起。推測所用的硫酸亞鐵溶液的濃度應越小越好;氫氧化鈉溶液濃度應越大越好。設計了如下實驗方案:
試管中10mLNaOH溶液 | 滴加FeSO4溶液 | 實驗現象 | |
實驗2 | 6 mol/LNaOH溶液 | 0.2mol/L FeSO4溶液 | 產生懸浮于液面的白色沉淀(帶有少量灰綠色),沉淀下沉后,大部分灰綠色變為白色沉淀 |
實驗3 | 6 mol/LNaOH溶液 | 0.1mol/L FeSO4溶液 | 產生懸浮于液面的白色沉淀(帶有極少量灰綠色),沉淀下沉后,底部都為白色沉淀 |
該實驗得出的結論是________。丙同學認為該實驗方案不足以證明灰綠色是由Fe(OH)2表面吸附Fe2+引起的,還需補充的實驗是__________,證明該假設成立。
(3)根據以上實驗探究,若盡可能制得白色Fe(OH)2沉淀,需要控制的實驗條件_____。
(4)下列情況會導致所配NaOH溶液的濃度偏高的是_______。
A.NaOH溶液未冷卻至室溫就進行定容 B.配制前容量瓶中有少量的水
C.配制溶液時,俯視容量瓶刻度線 D.加水時超過刻度線,用膠頭滴管吸出
查看答案和解析>>
科目: 來源: 題型:
【題目】被稱之為“軟電池”的紙質電池,其電池總反應為Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列說法正確的是( )
ZnO+2MnO(OH)。下列說法正確的是( )
A.該電池的正極為鋅
B.該電池反應中二氧化錳起催化劑作用
C.當65 g Zn完全溶解時,流經電極的電子為1mol
D.電池正極反應式為2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目: 來源: 題型:
【題目】用鉑電極電解100mLHNO3 與AgNO3 的混合液,通電一段時間后,兩極均收集到4.48L氣體(標準狀況),則原混合液中Ag+的物質的量濃度為( )
A. 1mol·L-1B. 2mol·L-1C. 2.5mol·L-1D. 4mol·L-1
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)將一塊未打磨過的鋁片放入裝有少量NaOH溶液的試管中,會發現開始沒有氣泡,一段時間后才產生氣泡。請寫出發生反應的離子方程式:___________,___________。
(2)將8gFe2O3投入到150mL某濃度的稀H2SO4中,再投入7g鐵粉收集到1.68LH2(標準狀況),同時,Fe與Fe2O3均無剩余,為了中和過量的硫酸,且使溶液中鐵元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。則原硫酸的物質的量濃度為________。
(3)請寫出制備漂白粉的離子方程式:____________。
(4)配平下列離子方程式:______Fe(OH)3+ClO-+OH-=FeO42-+Cl-+H2O。
查看答案和解析>>
科目: 來源: 題型:
【題目】研究表明氣孔的張開與保衛細胞膜上的H+—ATPase有著非常密切的關系。H+—ATPase被藍光誘導激活后就會利用ATP水解釋放的能量將H+分泌到細胞外,此時內向K+離子通道開啟,細胞外的K+轉移進保衛細胞;同時其他相關陰離子在H+協助下也進入保衛細胞,從而使氣孔張開。氣孔張開運動的相關機理如下圖所示。
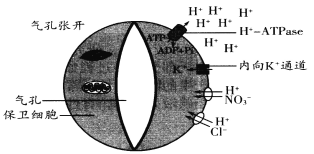
注:圖中兩個細胞貼近氣孔部分細胞壁較厚,伸縮性較小,外側較薄
(1)保衛細胞膜上的H+—ATPase被激活時,細胞內的H+通過____________的方式轉移出保衛細胞;據細胞吸水與失水的原理推測,藍光誘導后氣孔張開的原因是__________________。
(2)植物有時為防止水分過度散失氣孔會關閉,此時葉肉細胞仍可進行光合作用,消耗的CO2可來自___________和___________,但光合速率會明顯減慢;氣孔開啟瞬間植物葉肉細胞消耗C5的速率會___________(填“增大”或“減小”或“不變”)。
(3)科研人員利用轉基因技術在擬南芥保衛細胞中表達了由光控制的K+通道蛋白BL,試圖提高氣孔動力,即光照增強時氣孔打開的更快,光照減弱時關閉的也更快。
①欲探究BL蛋白是否發揮了此功能,可在變化的光照強度和恒定光照強度下,分別測正常植株和轉基因植株的氣孔動力,該實驗的自變量是_____________________。
②若實驗表明BL蛋白發揮了預期的作用,而在恒定光照強度下生長的轉基因株系生物量積累和用水效率方面,與正常植株無明顯差異,說明____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com