
科目: 來源: 題型:
【題目】[化學——選修5:有機化學基礎]
具有抗菌作用的白頭翁衍生物H的合成路線如圖所示:
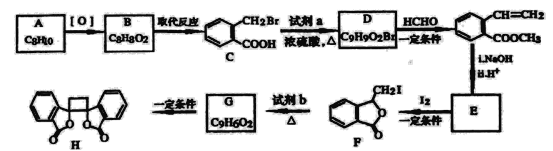
已知:
Ⅰ:R′CH2Br![]() R′HC=CH-R
R′HC=CH-R
Ⅱ: ![]()
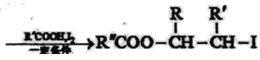
(1)A屬于芳香烴,其名稱是___________。
(2)寫出符合下列條件的B的一種同分異構體:①苯環上只有一個取代基,②能發生銀鏡反應,③能發生水解反應,該物質的結構簡式為___________。
(3)由C生成D的化學方程式是___________。
(4)由G生成H的反應類型是_________,1mol F與足量NaOH溶液反應,消耗__________mol NaOH。
(5)試劑b是_________。
(6)下列說法正確的是________(選填宇母序號)
a G存在順反異構體
b l mol G最多可以與1mol H2發生加成反應
c l mol H與足量NaOH溶液反應,消耗2mol NaOH
(7) 滿足下面條件的同分異構體共有________種。
滿足下面條件的同分異構體共有________種。
①含有苯環 ②含有2個-CHO ③苯環上有兩個取代基
查看答案和解析>>
科目: 來源: 題型:
【題目】(化學——選修3:物質結構與性質)
第23號元素釩在地殼中的含量大約為0.009%,在過渡元素中僅次于Fe、Ti、Mn、Zn,排第五位。我國四川攀枝花地區蘊藏著極其豐富的釩鈦磁鐵礦。
(1)釩在周期表中的位置為__________,電子占據的最高能層的軌道形狀為_______
(2)在地殼中含量最高的五種過渡金屬元素Fe、Ti、Mn、Zn、V中,基態原子核外單電子數最多的是_____。
(3)過渡金屬可形成許多羧基配合物,即CO作為配體形成的配合物。
①CO的等電子體有N2、CN-、_______等(任寫一個)。
②CO作配體時,配位原子是C而不是O,其原因是________。
(4)過渡金屬配合物常滿足“18電子規則”,即中心原子的價電子數加上配體提供的電子數之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都滿足這個規則。
①下列釩配合物中,釩原子滿足18電子規則的是__________。
A [V(H2O)6]2+ B [V(CN)6]4- C [V(CO)6]- D [V(O2)4]3-
②化合物 的熔點為138℃,其晶體類型為________。
的熔點為138℃,其晶體類型為________。
(5)VCl2(熔點1027℃)和VBr2(熔點827℃)均為六方晶胞,結構如圖所示。

①VCl2和VBr2兩者熔點差異的原因是_________。
②設晶體中陰、陽離子半徑分別為r-和r+,該晶體的空間利用率為________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目: 來源: 題型:
【題目】以CO2和H2為原料制取乙醇的反應為 2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) ΔH<0。某壓強下 的密閉容器中,按CO2和H2的物質的量比為 1∶3 投料,不同溫度下,達到平衡后平衡體系中各物質的物質的量分數(y%)隨溫度變化如圖所示。下列說法正確的是
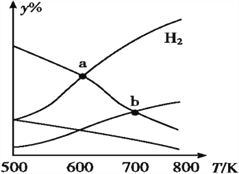
A. a點的平衡常數小于b點 B. b點:v正(CO2)=v逆(H2O)
C. a點:n(H2)=n(H2O) D. 溫度不變,充入更多H2,v(CO2)始終不變
查看答案和解析>>
科目: 來源: 題型:
【題目】食鹽是日常生活的必需品,也是重要的化工原料。粗食鹽常含有少量Ca2+、Mg2+、Fe3+、SO42-等雜質離子,實驗室提純NaC1的流程如下:
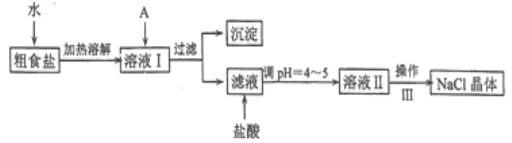
(1) 加入A試劑,是為了除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-離子。A代表的是多種試劑,按滴加順序依次為:i、NaOH,ⅱ、_____,ⅲ、_______(填化學式)。
(2) 下圖是某學生的過濾操作示意圖,其操作規范的是___________(填標號)。
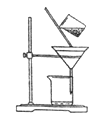
a.漏斗末端頸尖未緊靠燒杯壁
b.玻璃棒用作引流
c.將濾紙濕潤,使其緊貼漏斗壁
d.濾紙邊緣高出漏斗
e.用玻璃棒在漏斗中輕輕攪動以加快過濾速度
(3) 操作III的名稱是___。
(4) mg粗鹽提純后得到ng純凈的NaCl固體,則m與n的大小關系為__。
A.m>n B.m<n C.m=n D.無法確定.
(5) 實驗室需配制480 mL0.400mol/L鹽酸,現用如圖所示濃鹽酸配制,回答下列問題:
鹽酸
分子式: HCl
相對分子質量: 36.5
密度: 1.2g/cm3
HCl的質量分數為: 36.5%
需量取濃鹽酸的體積為:______mL。(結果保留1位小數)
查看答案和解析>>
科目: 來源: 題型:
【題目】在三個2 L恒容的容器中,分別發生反應A(g)+3B(g)![]() 2C(g),5min后各容器反應達平衡狀態,其中甲容器中A的物質的量為0.4 mol。下列說法正確的是()
2C(g),5min后各容器反應達平衡狀態,其中甲容器中A的物質的量為0.4 mol。下列說法正確的是()
反應前各物質的物質的量/mol
A | B | C | |
甲 | 1 | 3 | 0 |
乙 | 0 | 0 | 2 |
丙 | 1.5 | 4.5 | 1 |
A.乙中5min內C的反應速率為0.16mol-1·min-1
B.達到平衡時,丙中A的濃度是甲中的2倍
C.丙中反應的平衡常數大于甲中反應的平衡常數
D.達到平衡時,甲、乙兩容器中C的物質的量相等
查看答案和解析>>
科目: 來源: 題型:
【題目】下列圖示與對應的敘述一定正確的是( )


A. 圖1表示合成氨(放熱反應),溫度T1和T2對應的平衡常數為K1、K2,則T1<T2,K1>K2
B. 圖2所示,反應:X(g)+2Y(g)![]() 3Z(g),b的溫度比a高
3Z(g),b的溫度比a高
C. 圖3表明,該溫度下,加入FeCl3不可能引起由b向a的變化
D. 圖4所示,用水稀釋pH相同的鹽酸和醋酸,Ⅰ表示鹽酸,Ⅱ表示醋酸,且溶液導電性:c>b>a
查看答案和解析>>
科目: 來源: 題型:
【題目】雙氧水(過氧化氫的水溶液)在工業生產和日常生活中應用廣泛。
(1)雙氧水常用于傷口消毒,這一過程利用了過氧化氫的_________(填過氧化氫的化學性質)。
(2)火箭推進器中盛有強還原劑液態肼(N2H4)和強氧化劑液態過氧化氫。已知0.4 mol液態肼與足量的液態過氧化氫反應,生成氮氣和水蒸氣,并放出256.652kJ的熱量。該反應的熱化學方程式為__________。
(3)雙氧水能將堿性廢水中的CN-轉化成碳酸鹽和一種對環境無污染的氣體,CN-的電子式為________,寫出該反應的離子方程式________。
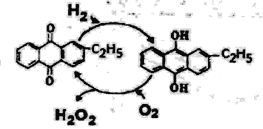
(4)下圖是工業上制備過氧化氫最常見的方法,寫出實際發生反應的總方程式_______。
(5)下圖是一種用電解原理來制備H2O2,并用產生的H2O2處理廢氨水的裝置。
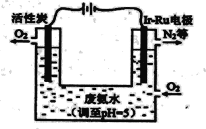
①Ir-Ru惰性電極吸附O2生成H2O2,其電極反應式是_______。
②處理廢氨水中溶質(以NH3計)的質量是34g,理論上電路中轉移電子數為__________mol。
查看答案和解析>>
科目: 來源: 題型:
【題目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入足量NaOH溶液,充分反應后消耗 a mol NaOH ,另取一份加入足量鹽酸,充分反應后消耗b mol HCl,則該混合溶液中c(Na+)為 ( )(已知:NH4++ OH—= NH3·H2O)
A.(![]() )mol/LB.(5a—
)mol/LB.(5a—![]() )mol/L
)mol/L
C.(10b-5a) mol/LD.(2b-a) mol/L
查看答案和解析>>
科目: 來源: 題型:
【題目】按要求填空:
(1)有四種物質:①氧化鐵 ②硫酸 ③碳酸氫鈉 ④氫氧化鈉
①屬于鹽的是________(填序號),寫出這種物質在水溶液中的電離方程式__________。
②上述物質中有一種與其他三種物質均能反應,此物質是__________(填序號)。
(2)酸性條件下,次磷酸(H3PO2)可發生下列反應而用于化學鍍銀。
口Ag++口H3PO2+口 =口Ag+口H3PO4+口
試回答下列問題
①該反應的氧化產物是_________。
②請將反應物和生成物補充完整并配平,并用雙線橋法標出電子轉移的數目。______
③若反應中生成10.8gAg,則轉移電子的數目約為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】釀酒和造醋是古代勞動人民的智慧結晶,白酒和醋也是日常生活中常見的有機物。
(1)上述以高粱為主要原料的釀醋工藝中,利用醋酸溶解性的是_________(填選項)。
(2)寫出乙酸在水溶液中的電離平衡常數的表達式________。
(3)已知25℃下,CH3COOH在水中電離的電離常數Ka=2×10-5,則25℃時CH5COONa水解平衡常數Kh=_________(填數值)。
(4)近年來,研究者利用乙酸開發出新工藝合成乙酸乙酯,使產品成本明顯降低,其主要反應為: CH2=CH2 (g)+CH3COOH(l) ![]() CH3COOC2H5(l)。
CH3COOC2H5(l)。
①該反應屬于有機反應類型中的___________。
②下列描述能說明乙烯與乙酸合成乙酸乙酯的反應已達化學平衡的是_________(填選項)。
A 乙烯、乙酸、乙酸乙酯的濃度相同
B 酯化合成反應的速率與酯分解反應的速率相等
C 乙烯斷開l mol碳碳雙鍵的同時乙酸恰好消耗l mol
D 體系中乙酸的百分含量一定
(5)下圖為n(乙烯)與n(乙酸)物料比為1時,在不同壓強下進行了乙酸乙酯的產率隨溫度變化的測定實驗,在相同時間點的實驗結果如圖所示。回答下列問題:
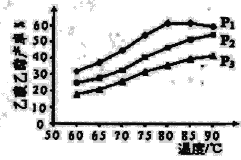
①溫度在60-80℃范圍內,乙烯與乙酸酯化合成反應速率由大到小的順序是_______[用v(P1)、v(P2)、v(P3)分別表示不同壓強下的反應速率]。
②壓強為P1 MPa、溫度60℃時,若乙酸乙酯的產率為30%,則此時乙烯的轉化率為_______。
③壓強為P1 MPa、溫度超過80℃時,乙酸乙酯產率下降的原因可能是___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com