
【題目】[化學——選修5:有機化學基礎]
具有抗菌作用的白頭翁衍生物H的合成路線如圖所示:
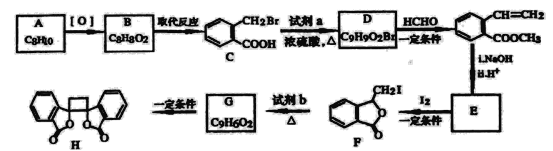
已知:
Ⅰ:R′CH2Br![]() R′HC=CH-R
R′HC=CH-R
Ⅱ: ![]()
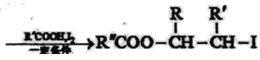
(1)A屬于芳香烴,其名稱是___________。
(2)寫出符合下列條件的B的一種同分異構體:①苯環上只有一個取代基,②能發生銀鏡反應,③能發生水解反應,該物質的結構簡式為___________。
(3)由C生成D的化學方程式是___________。
(4)由G生成H的反應類型是_________,1mol F與足量NaOH溶液反應,消耗__________mol NaOH。
(5)試劑b是_________。
(6)下列說法正確的是________(選填宇母序號)
a G存在順反異構體
b l mol G最多可以與1mol H2發生加成反應
c l mol H與足量NaOH溶液反應,消耗2mol NaOH
(7)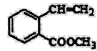 滿足下面條件的同分異構體共有________種。
滿足下面條件的同分異構體共有________種。
①含有苯環 ②含有2個-CHO ③苯環上有兩個取代基
【答案】1,2-二甲苯(鄰二甲苯) 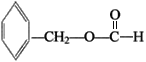
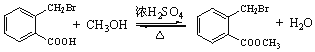 加成反應 2 NaOH醇溶液 c 12種
加成反應 2 NaOH醇溶液 c 12種
【解析】
由A的分子式、C的結構簡式,可知芳香烴A為![]() ,結合B的分子式與C的結構,可知B為
,結合B的分子式與C的結構,可知B為![]() ,B與液溴在光照條件下反應得到C.由D的分子式、D后產物結構,結合信息i,可推知D為
,B與液溴在光照條件下反應得到C.由D的分子式、D后產物結構,結合信息i,可推知D為![]() ,則C與甲醇發生酯化反應生成D,故試劑a為CH3OH.D后產物發生酯的堿性水解、酸化得到E為
,則C與甲醇發生酯化反應生成D,故試劑a為CH3OH.D后產物發生酯的堿性水解、酸化得到E為![]() .由H的結構,結合信息ii可知F為
.由H的結構,結合信息ii可知F為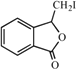 ,F發生消去反應生成G為
,F發生消去反應生成G為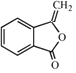 ,G發生加成反應得到H。
,G發生加成反應得到H。
(1)A是![]() ,其名稱是:鄰二甲苯。
,其名稱是:鄰二甲苯。
(2)①苯環上只有一個取代基,②能發生銀鏡反應,含有醛基,③能發生水解反應,含有酯基,是甲酸酯,符合上列條件的B的一種同分異構體: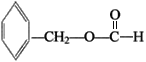 ;
;
(3)由C生成D的化學方程式是 。
。
(4)G含有碳碳雙鍵,由G生成H的反應是加成反應,F為 ,含有酯基和I原子,水解生成的羧基和HI可與NaOH溶液反應,1mol F與足量NaOH溶液反應,消耗2mol NaOH。
,含有酯基和I原子,水解生成的羧基和HI可與NaOH溶液反應,1mol F與足量NaOH溶液反應,消耗2mol NaOH。
(5)試劑b是NaOH醇溶液,F發生消去反應生成G為 。
。
(6)a.G為 ,不存在順反異構體,故a錯誤;
,不存在順反異構體,故a錯誤;
b.1mol G最多可以與4mol H2發生加成反應,故b錯誤;
c.1mol H含有兩摩爾酯基,與足量NaOH溶液反應,消耗2molNaOH,故c正確。
(7)①含有苯環 ②含有2個-CHO ③苯環上有兩個取代基分為四種情況,-CHO和-CH2CH2CHO、-CHO和-CH(CH3)CHO、兩個-CH2CHO、-CH3和-CH(CHO)2,每種情況兩個原子團在苯環上分布均有鄰、間、對,三種情況, 滿足下面條件的同分異構體共有4×3=12種。
滿足下面條件的同分異構體共有4×3=12種。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】在100 mL H2SO4和CuSO4的混合液中,用石墨作電極進行電解,兩極上均收集到2.24 L氣體(標準狀況下),則原混合液中Cu2+的物質的量濃度為( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】火箭的燃料之一是鋁粉與高氯酸銨(NH4ClO4)的固體混合物,點燃時,鋁粉被氧化。放熱引發高氯酸銨反應:2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑,反應放出大量熱。
(1)該反應中被氧化的元素是___和___;
(2)氧化產物與還原產物的質量之比為___;
(3)該反應中若生成標況下2.24LCl2時,電子轉移數為___;
(4)若生成的水在高溫下也為氣態,則混合氣體的平均摩爾質量為__g/mol(小數點后保留一位)。
(5)高鐵酸鉀(K2FeO4)是一種強氧化劑,易溶于水,可作為水處理劑和高容量電池材料。FeCl3和KClO在強堿性條件下反應可制取K2FeO4,其反應的離子方程式為:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四元軸烯t,苯乙烯b及立方烷c的結構簡式如下,下列說法正確的是
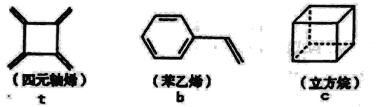
A.b的同分異構體只有t和c兩種B.t和b能使酸性KMnO4溶液褪色而c不能
C.t、b、c的二氯代物均只有三種D.b中所有原子-定不在同-個平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述一定正確的是( )


A. 圖1表示合成氨(放熱反應),溫度T1和T2對應的平衡常數為K1、K2,則T1<T2,K1>K2
B. 圖2所示,反應:X(g)+2Y(g)![]() 3Z(g),b的溫度比a高
3Z(g),b的溫度比a高
C. 圖3表明,該溫度下,加入FeCl3不可能引起由b向a的變化
D. 圖4所示,用水稀釋pH相同的鹽酸和醋酸,Ⅰ表示鹽酸,Ⅱ表示醋酸,且溶液導電性:c>b>a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲線如圖。下列說法正確的是()
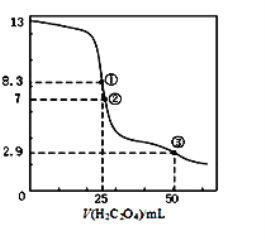
A.點①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.點②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.點③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定過程中可能出現:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.硫酸工業中廢渣稱為硫酸渣,其成分為SiO2、Fe2O3、Al2O3、MaO。某學習小組的同學設計以下方案,進行硫酸渣中金屬元素的提取實驗。

已知:溶液pH=3.7時,Fe3+已經沉淀完全;一水合氨其飽和溶液中c(OH-)約為1×10-3mol·L-1。
(1)寫出A與氫氧化鈉溶液反應的離子方程式:______________________________。
(2)上述流程中兩次使用試劑①,推測試劑①應該是____________(填字母)
A.氫氧化鈉 B.氧化鋁 C.氨水 D.水
(3)H中溶質是______________。(填化學式)
(4)溶液D到固體E過程中需要控制溶液pH=13,如果pH過小,可能導致的后果是______________ 。
(4)計算溶液F中c(Mg2+)=______________ (25℃時,氫氧化鎂的Ksp=5.6×10-12)
II.某化學興趣小組用下圖所示裝置進行電化學原理的實驗探究。
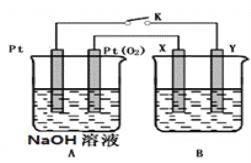
(1)A裝置為乙醇燃料電池,若X、Y均是銅,電解質溶液為NaOH溶液,電池工作一段時間,X極附近生成磚紅色沉淀,查閱資料得知是Cu2O,試寫出該電極發生的電極反應式為________________________。
(2)若B電池的電解質溶液為500mL1.0mol/L的NaCl溶液,X、Y皆為惰性電極,當電池工作一段時間斷開電源K,Y電極有560mL(標準狀況)無色氣體生成(假設電極產生氣體完全溢出,溶液體積不變)此時B電池溶液的pH=____________,要是該溶液恢復到原來的狀態,需加入____________(填物質并注明物質的量)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.56gN2與CO的混合物中原子總數是4NA
B.0.1mol/L的硫酸溶液中含H+的數目為0.2 NA
C.3mol單質Fe完全燃燒轉變為Fe3O4,Fe得到8NA個電子
D.標準狀況下,22.4LH2O所含的氧原子數目為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室采用如下圖所示的裝置制取氯化銅(部分儀器和夾持裝置已略去)。
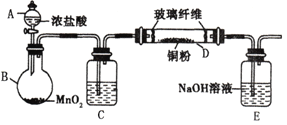
(1)C中試劑是____________。
(2)下列說法不正確的是______________。
A.玻璃纖維的作用是防止E中液體倒吸入D中
B.E中液體用于吸收多余的氯氣和氯化氫
C.要使B中產生氯氣,應先加熱圓底燒瓶,再滴加濃鹽酸
D.實驗中加熱的先后順序為:先加熱圓底燒瓶B,再加熱硬質玻璃管D
(3)寫出B 中反應的離子方程式___________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com