
科目: 來源: 題型:
【題目】某礦石含碳酸鎂和石英,制備高純硅和硅膠的工藝流程如下:

(1)“硅膠”冶常用作_______________ ,也可以用作__________的載體。 A 的結構式為________。
(2)制備粗硅的方程式為_______。
(3)操作I為_____________,操作Ⅱ為_______________,操作Ⅲ所用儀器有鐵架臺(帶鐵圈)、酒精燈、_______________等。
(4)操作Ⅲ,需要在氯化氫氣流中加熱脫水的原因是_______________。
(5)溶液G用E酸化的方程式為_______________。
(6)電解飽和的K溶液的離子方程式為____________,陽極電極方程式為_______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于電解質溶液的說法錯誤的是
A.pH=3的 NH4Cl溶液與pH=3的鹽酸中,水電離的c(H+)相等
B.25℃時將0.1mol·L -1 的HF加水不斷稀釋,![]() 不變
不變
C.K2SO3溶液中加入少量NaOH固體,溶液的pH增大,SO32-水解程度減小
D.pH=5的CH3 COOH 與CH3COONa混合溶液中,c(CH3COO-)<c(Na+)
查看答案和解析>>
科目: 來源: 題型:
【題目】可逆反應:2NO2![]() 2NO+O2在恒容密閉容器中反應,達到平衡狀態的標志是( )
2NO+O2在恒容密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成n molO2的同時生成2n molNO2;
②單位時間內生成n molO2的同時生成2n mol NO;
③用NO2、NO、O2的物質的量濃度變化表示的反應速率的比為2:2:1的狀態;
④混合氣體中![]() 不變;
不變;
⑤混合氣體的顏色不再改變的狀態;
⑥混合氣體的密度不再改變的狀態;
⑦混合氣體的平均相對分子質量不再改變的狀態.
A. ①⑤⑥ B. ①④⑤⑦ C. ①⑤⑥⑦ D. ①③⑤⑥⑦
查看答案和解析>>
科目: 來源: 題型:
【題目】氯乙烯是合成聚氯乙烯的單體。乙烯氧化法是生產氯乙烯的主要方法分三步進行。如圖所示:

(1)關于乙烯、氯乙烯、聚氯乙烯說法正確的是____________;
A.都能在氧氣中燃燒 B.都能發生加成反應使溴水褪色
C.都能使得酸性高錳酸鉀褪色 D.氯乙烯分子中所有原子共平面
(2)圖中A物質的化學式為_________;
(3)從環境角度考慮,氧化法的優點是_________;
(4)請寫出③化學方程式_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組為研究電化學原理,設計如圖裝置。下列敘述不正確的是
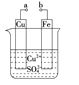
A.a和b不連接時,鐵片上會有金屬銅析出
B.a和b用導線連接時,銅片上發生的反應為:Cu2++2e-===Cu
C.無論a和b是否連接,鐵片均會溶解,溶液均從藍色逐漸變成淺綠色
D.a和b連接時,銅片上發生氧化反應
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)請正確表示下列化學用語:
乙炔(結構式) ;甲烷(空間構型) ;羥基(電子式) ;
C22-(電子式) _________ ;1,3-丁二烯(實驗式) 。
(2)高分子化合物![]() 是由三種單體通過加聚反應而制得的。這三種單體的結構簡式是 、 、 ;
是由三種單體通過加聚反應而制得的。這三種單體的結構簡式是 、 、 ;
(3)提純下列物質(括號內為雜質)
①NaCl(KNO3)固體中提取NaCl固體: 。
②KNO3(NaCl)溶液中得KNO3固體: 。
③乙醇(水)混合物中得無水乙醇: 。
④溴苯(溴)混合物中得溴苯: 。
查看答案和解析>>
科目: 來源: 題型:
【題目】四苯基乙烯(TPE)及其衍生物具有聚集誘導發光特性,在光電材料等領域應用前景廣闊。以下是TPE的合成路線(部分試劑和反應條件省略):
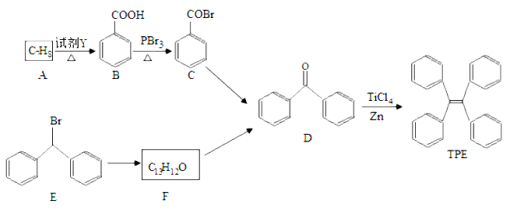
(1)A的名稱是 ;試劑Y為 。
(2)B→C的反應類型是 ;B中官能團的名稱是 ; D中官能團的名稱 。
(3)E→F的化學方程式是 。
(4)W是D的同分異構體,具有下列結構特征:屬于萘(![]() )的一元取代物;存在羥甲基(—
)的一元取代物;存在羥甲基(—
CH2OH)。寫出W所有可能的結構簡式: 。
(5)下列說法正確的是 ( )
a.B的酸性比碳酸強 b.D不能發生還原反應
c.E含有3種不同化學環境的氫 d.TPE既屬于芳香烴也屬于烯烴
查看答案和解析>>
科目: 來源: 題型:
【題目】甲烷的用途很廣泛。
(1)已知:
2NO2(g )![]() N2O4(g) △H= -56.9kJ·mol -1
N2O4(g) △H= -56.9kJ·mol -1
H2 O(g)= H2O(l) △H= -44.0kJ·mol -1
CH4(g)+N2O4 (g)= N2(g)+2H2O(l)+CO2 (g) △H=-898.1kJ·mol -1
則 CH4 (g)催化還原NO2 (g)生成 N2(g)和H2O(g)的熱化學方程式為_____________________。
(2)一定條件下,發生2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H<0。在不同時間c(NO)與c(CO)如下表所示:
N2(g) +2CO2(g) △H<0。在不同時間c(NO)與c(CO)如下表所示:

①該溫度下,該反應的平衡常數表達式為K =_____________________;
②計算前4秒內氮氣的平均反應速率為____________________;
③下列選項中,不能說明上述反應已達平衡的是( )
A.2v正(NO)= v逆(N2 )
B.容器中氣體的平均分子量不隨時間而變化
C.容器中氣體的密度不隨時間而變化
D.容器中CO的質量不再發生變化
E. 容器中氣體的總壓強不隨時間而變化
(3)CH4燃料電池原理如圖所示

①該燃料電池的正極為_______________(填“a”或“b”)。該電池負極的電極反應式為_____________;
②放電一段時間后,電解質溶液的pH___________(填“增大”、“減小”或“不變”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】某工廠的廢渣中含NaCl、Mg ( OH) 2、CaCO3、BaCO3等,為實現變廢為寶,設計了以下工藝流程制備七水硫酸鎂。

在廢渣中加入過量的稀硫酸,控制 pH為5.0,溫度在52℃左右,用攪拌器持續攪拌。
(1)攪拌的作用是為使反應充分進行,其化學原理為_____________________________;
(2)經過分析,過濾所得濾液中含有的離子的主要為 Na+、Mg2+、H+、SO42-、Cl-,為了除去H+,最好加入適量的_____________________________ (填化學式)。
(3)蒸發濃縮器的溶液中主要含有氯化鈉和硫酸鎂,通入高溫水蒸汽并控制溫度在100 ~ 110℃,蒸發濃縮結晶,此時析出的晶體主要是氯化鈉,說明此溫度下硫酸鎂的溶解度比氯化鈉____________ (“大”或“小”)。 結晶槽中硫酸鎂結晶的方法為_______________。
(5)為了檢驗所得 MgSO4·7H2O 是否純凈,具體的操作為____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】在一定溫度下,將0.2mol的碘化氫充入1L的密閉容器中,充分反應,達到平衡后,測得c(H2)=0.08mol/L.
(1)求該反應的平衡常數。
(2)在上述溫度下,該容器中若充入碘化氫0.4mol,求達到 平衡時碘化氫的轉化率和氫氣的物質的量濃度。2HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com