
科目: 來源:2017屆黑龍江省牡丹江市高三2月開學檢測理綜化學試卷(解析版) 題型:簡答題
(1)已知在常溫常壓下:
①CH3CH2OH(l)+3O2(g) 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44kJ·mol-1
④CH3CH2OH(l)+2O2(g) 2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
則 CO的燃燒熱 ΔH =_________。
在圖中畫出,不同溫度下(T1>T2),上述反應④中O2的平衡轉化率隨壓強變化的關系圖(請在圖上標注溫度T1、T2)。_________
(3)一定條件下,在體積為3 L的密閉容器中反應CO(g) + 2H2(g) CH3OH(g)達到化學平衡狀態。
CH3OH(g)達到化學平衡狀態。
①反應的平衡常數表達式K=__________;根據下圖,升高溫度,K值將___________(填“增大”、“減小”或“不變”)。
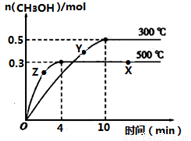
②500℃時,從反應開始到達到化學平衡,以H2的濃度變化表示的化學反應速率是________。
③X點與Y點的平均速率:v(X)_________v(Y);其中X點的正反應速率v正(X)與Z點的逆反應速率v逆(Z)的大小關系為v正(X)________v逆(Z)(填“>”、“<”、“=”)。
④300℃時能夠說明該可逆反應達到化學平衡狀態的標志是____________ (填字母)。
a.v生成(CH3OH) = v生成(H2) b.混合氣體的密度不再改變
c.混合氣體的平均相對分子質量不再改變 d.CO、H2、CH3OH的濃度相等
⑤500℃時,將容器的容積壓縮到原來的1/2,在其他條件不變的情況下,對平衡體系產生的影響是___________。(填字母)
a.c(H2)減少 b.正反應速率加快,逆反應速率減慢
c.CH3OH 的百分含量增加 d.重新平衡時c(H2)/ c(CH3OH)減小
查看答案和解析>>
科目: 來源:2017屆黑龍江省牡丹江市高三2月開學檢測理綜化學試卷(解析版) 題型:簡答題
低濃度SO2廢氣的處理是工業難題,工業上常利用廢堿渣(主要成分Na2CO3)吸收硫酸廠尾氣中的SO2制備無水Na2SO3的成本低,優勢明顯,其流程如下。
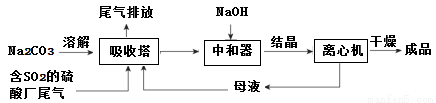
(1)為了使SO2盡可能吸收完全,在不改變吸收塔體積的條件下,可以采取的合
理措施______________、_______________。(寫出兩條)
(2)中和器中發生的主要反應的離子方程式是_____________________。
(3)下圖為吸收塔中Na2CO3溶液與SO2反應過程中溶液組成變化。

①則初期反應(圖中A點以前)的化學方程式是__________________。
②通過電解法可分離圖中B點NaHSO3與Na2SO3混合物,實現Na2SO3的循環利用,示意圖如下:
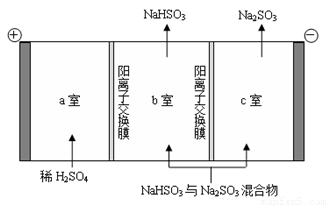
簡述分離NaHSO3與Na2SO3混合物的原理___________________。
(4)下圖是亞硫酸鈉的溶解度曲線(溫度在33℃前后對應不同物質),下列說法正確的是______

A.a點時溶液為不飽和溶液
B.b點時Na2SO3·7H2O和無水Na2SO3共存
C.制備無水Na2SO3,應該在95~100℃加熱濃縮,冷卻至室溫結晶
(5)如果用含等物質的量溶質的下列各溶液分別吸收SO2,則理論吸收量最多的是__________
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
科目: 來源:2017屆黑龍江省牡丹江市高三2月開學檢測理綜化學試卷(解析版) 題型:簡答題
鈦的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有著廣泛用途。
(1)寫出Ti的基態原子的外圍電子排布式____________。
(2)TiCl4熔點是-25℃,沸點136.4℃,可溶于苯或CCl4,該晶體屬于_____晶體;BH4-中B原子的雜化類型為____________;
(3)在 TiO2催化作用下,可將CN-氧化成CNO-,進而得到N2。與CNO-互為等電子體的分子化學式為_________________。
(4)Ti3+可以形成兩種不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2•H2O(綠色),兩者配位數_____(填“相同”或“不同”),綠色晶體中配體是______。
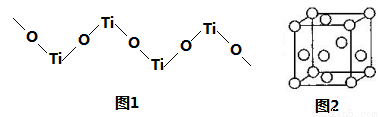
(5)TiO2難溶于水和稀酸,但能溶于濃硫酸,析出含有鈦酰離子的晶體,鈦酰離子常成為鏈狀聚合形式的陽離子,其結構形式如圖1,化學式為____________。
(6)金屬鈦內部原子的堆積方式是面心立方堆積方式,如圖2。若該晶胞的密度為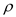 g/cm3,阿伏加德羅常數為NA,則該晶胞的邊長為______________cm。
g/cm3,阿伏加德羅常數為NA,則該晶胞的邊長為______________cm。
查看答案和解析>>
科目: 來源:2017屆黑龍江省牡丹江市高三2月開學檢測理綜化學試卷(解析版) 題型:推斷題
對乙酰氨基酚,俗稱撲熱息痛(Paracetamol),具有很強的解熱鎮痛作用,工業上通過下列方法合成(圖中B1和B2、C1和C2分別互為同分異構體,無機產物略去):
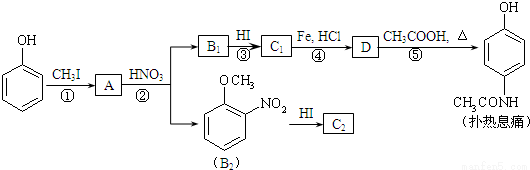
已知: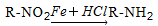 ,請按要求填空:
,請按要求填空:
⑴寫出A分子中官能團名稱:_________;C1的結構簡式為:________________。
⑵寫出由D生成撲熱息痛的化學方程式:_______________________。
⑶寫出反應③和④的反應類型:③______________,④__________。
⑷工業上設計反應①、②、③,而不是只通過反應②得到C1、C2,其目的是:______________________。
⑸撲熱息痛有很多同分異構體,符合下列要求的同分異構體有5種:(I)是對位二取代苯;(II)苯環上兩個取代基一個含氮不含碳、另一個含碳不含氮;(III)兩個氧原子與同一原子相連。其中2種的結構簡式是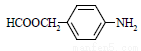 和
和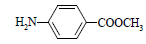 ,寫出另3種同分異構體的結構簡式____________、____________、____________。
,寫出另3種同分異構體的結構簡式____________、____________、____________。
查看答案和解析>>
科目: 來源:2016-2017學年甘肅省天水市高二下學期開學考試化學試卷(解析版) 題型:選擇題
下列說法錯誤的有
①化學反應除了生成新物質外,還伴隨著能量的變化
②放熱反應不需要加熱就能發生
③需要加熱才能發生的反應都是吸熱反應
④化學反應放熱還是吸熱。決定于生成物具有的總能量和反應物具有的總能量的大小
⑤熱化學方程式應注明反應時的溫度與壓強,如沒注明則表示常溫常壓時的反應
⑥等量的氫氣和氧氣分別完全燃燒生成氣態水和液態水,前者放出的熱量多
⑦H2(g)+I2(g)  2HI(g) ΔH=-QkJ·mol-1表示常溫常壓下,在恒溫密閉容器中當有1mol H2和1mol I2(g)反應生成2 mol HI時放出QkJ的熱量
2HI(g) ΔH=-QkJ·mol-1表示常溫常壓下,在恒溫密閉容器中當有1mol H2和1mol I2(g)反應生成2 mol HI時放出QkJ的熱量
⑧同溫同壓下,H2(g)+Cl2(g)===2HCl(g)在光照條件下和點燃條件下的ΔH相同
A. 2項 B. 3項 C. 4項 D. 5項
查看答案和解析>>
科目: 來源:2016-2017學年甘肅省天水市高二下學期開學考試化學試卷(解析版) 題型:選擇題
廢電池造成污染的問題日益受到關注。下列有關電池的說法正確的是
A. 構成原電池的正極和負極必須是兩種不同的金屬
B. 弱電解質在水中的電離程度報小,不能用作電池的電解質溶液
C. 原電池是將化學能完全轉變為電能的裝置
D. 回收廢舊電池,可防止汞、鎘和鉛等重金屬對土壤和水源的污染
查看答案和解析>>
科目: 來源:2016-2017學年甘肅省天水市高二下學期開學考試化學試卷(解析版) 題型:選擇題
銅鋅原電池(如圖)工作時,下列敘述正確的是
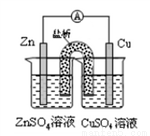
A. 在外電路中,電流從Zn極流向Cu極 B. 鹽橋中的Cl-移向CuSO4溶液
C. 當負極減小65g時,正極增如65g D. 電池的總反應為Zn+Cu2+=Zn2++Cu
查看答案和解析>>
科目: 來源:2016-2017學年甘肅省天水市高二下學期開學考試化學試卷(解析版) 題型:選擇題
化學用語是學習化學的重要工具,下列化學用語中,正確的是
A. NH4+的水解反應離子方程式:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
B. 在AgCl懸濁液中加入KI溶液充分振蕩:Ag++I-=AgI↓
C. 鍍銅時,陽極的電極反應式為:Cu2++2e-═Cu
D. 某反應△H<0,則該反應在任意條件下均可自發進行
查看答案和解析>>
科目: 來源:2016-2017學年甘肅省天水市高二下學期開學考試化學試卷(解析版) 題型:選擇題
在一定溫度下,下列敘述是可逆反應A(g)+3B(g) 2C(g)在定容密閉容器中達到平衡的標志的是
2C(g)在定容密閉容器中達到平衡的標志的是
①C的生成速率與C的分解速率相等;
②單位時間內amol A生成,同時生成3amol B;
③A、B、C的濃度不再變化;
④混合氣體的總壓強不再變化;
⑤混合氣體的平均摩爾質量不再變化;
⑥用A、B、C的物質的量濃度變化表示的反應速率之比為1:3:2;
⑦A、B、C的分子數目比為1:3:2;
⑧混合氣體的密度不再變化。
A. ②⑤ B. ①③④⑤ C. ②⑥⑦⑧ D. ⑤⑥⑧
查看答案和解析>>
科目: 來源:2016-2017學年甘肅省天水市高二下學期開學考試化學試卷(解析版) 題型:選擇題
下列實驗誤差分析正確的是
A. 用潤濕的pH試紙測稀堿溶液的pH,測定值偏小
B. 用容量瓶配制溶液,定容時俯視刻度線,所配溶液濃度偏小
C. 滴定前滴定管內無氣泡,終點讀數時有氣泡,讀取滴定溶液體積偏小
D. 測定中和反應的反應熱時,將堿緩慢倒入酸中,所測溫度差偏小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com