
科目: 來源: 題型:解答題
| 時間t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 總壓強p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |

查看答案和解析>>
科目: 來源: 題型:解答題
 氮的固定是指將氮元素由游離態轉化為化合態的過程.
氮的固定是指將氮元素由游離態轉化為化合態的過程.| 溫度/℃ | 1538 | 1760 | 2404 |
| 平衡常數K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
 PM2.5污染跟工業燃煤密切相關,燃煤還同時排放大量的SO2和NOX.
PM2.5污染跟工業燃煤密切相關,燃煤還同時排放大量的SO2和NOX.查看答案和解析>>
科目: 來源: 題型:解答題
 )甲酯并計算其產率.實驗步驟如下:
)甲酯并計算其產率.實驗步驟如下: 水形成的共沸物,其沸點為85℃;該實驗中加入甲苯,易將水蒸出),再小心地加入5mL濃硫酸,搖動混勻后加入1~2粒沸石,組裝好實驗裝置,在85~95℃下恒溫加熱反應1.5小時:
水形成的共沸物,其沸點為85℃;該實驗中加入甲苯,易將水蒸出),再小心地加入5mL濃硫酸,搖動混勻后加入1~2粒沸石,組裝好實驗裝置,在85~95℃下恒溫加熱反應1.5小時:| 名稱 | 分子量 | 顏色狀態 | 相對密度 | 熔點(℃) | 沸點(℃) |
| 水楊酸甲酯 | 152 | 無色液體 | 1.18 | -8.6 | 224 |
| 水楊酸 | 138 | 白色晶體 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 無色液體 | 0.792 | -97 | 64.7 |

查看答案和解析>>
科目: 來源: 題型:解答題

| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸點/℃ | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
科目: 來源: 題型:填空題
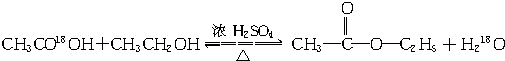 .
.
查看答案和解析>>
科目: 來源: 題型:填空題
 乙酰水楊酸俗稱阿司匹林(
乙酰水楊酸俗稱阿司匹林( ),是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.實驗室以水楊酸(鄰羥基苯甲酸)與乙酸酐[(CH3CO)2O]為主要原料合成阿司匹林,其制備原理為:
),是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.實驗室以水楊酸(鄰羥基苯甲酸)與乙酸酐[(CH3CO)2O]為主要原料合成阿司匹林,其制備原理為:
| 名稱 | 相對分子質量 | 熔點或沸點(℃) | 水 |
| 水楊酸 | 138 | 158(熔點) | 微溶 |
| 乙酸酐 | 102 | 139.4(沸點) | 反應 |
| 乙酰水楊酸 | 180 | 135(熔點) | 微溶 |
查看答案和解析>>
科目: 來源: 題型:填空題


| 密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
| 環己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
查看答案和解析>>
科目: 來源: 題型:解答題
 對叔丁基苯酚
對叔丁基苯酚 工業用途廣泛,可用于生產油溶性酚醛樹脂、穩定劑和香料等.實驗室以苯酚、叔丁基氯[(CH3)3CCl]等為原料制備對叔丁基苯酚.實驗步驟如下:反應物和產物的相關數據列表如下:
工業用途廣泛,可用于生產油溶性酚醛樹脂、穩定劑和香料等.實驗室以苯酚、叔丁基氯[(CH3)3CCl]等為原料制備對叔丁基苯酚.實驗步驟如下:反應物和產物的相關數據列表如下: .該反應過于激烈,放出大量熱,常使實驗的產率降低,可能的原因是由于叔丁基氯揮發導致產率降低.
.該反應過于激烈,放出大量熱,常使實驗的產率降低,可能的原因是由于叔丁基氯揮發導致產率降低.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com