
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
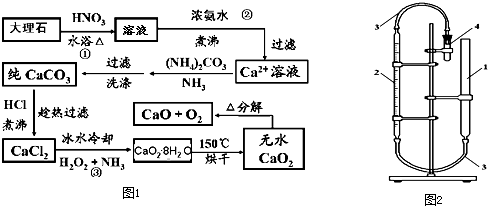
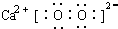 .
.查看答案和解析>>
科目: 來源: 題型:解答題
| 時間/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
 產生的氫氣經干燥裝置并用針筒收集;V(H2)隨時間t變化如右圖所示.下列敘述正確的是BC(雙選題).
產生的氫氣經干燥裝置并用針筒收集;V(H2)隨時間t變化如右圖所示.下列敘述正確的是BC(雙選題).查看答案和解析>>
科目: 來源: 題型:解答題

| 所含離子 | 檢驗方法 |
| K+ | 取少量濾液于試管中,通過焰色反應,火焰呈紫色(透過藍色鈷玻璃) |
| NH4+ | 取少量濾液于試管中,并向其中加入NaOH微熱,有刺激性氣味產生(該氣體可使濕潤紅色石蕊試紙變藍) |
查看答案和解析>>
科目: 來源: 題型:解答題
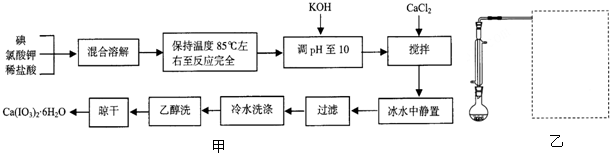
查看答案和解析>>
科目: 來源:2016-2017學年遼寧沈陽東北育才學校高二階段考一化學卷(解析版) 題型:選擇題
合成氨反應為 N2(g)+3H2(g)  2NH3(g)△H=+92.4kJ•mol﹣1,下列說法正確的是( )
2NH3(g)△H=+92.4kJ•mol﹣1,下列說法正確的是( )
A.一定條件下,當N2的生成速率與N2的分解速率相等時,該反應處于平衡狀態
B.取1mol N2和3mol H2放在密閉容器內反應達平衡時,生成2 mol NH3
C.一定條件下反應達到平衡,再充入N2,則正反應速率增大,逆反應速率減小
D.一定條件下反應達到平衡,若升高溫度,反應速率增大,平衡向正反應方向移動
查看答案和解析>>
科目: 來源:2016-2017學年遼寧沈陽東北育才學校高二階段考一化學卷(解析版) 題型:選擇題
一定條件下將0.1mol N2和0.3mol H2置于恒容密閉容器中發生反應:N2+3H2 2NH3.下列關于該反應的說法正確的是( )
2NH3.下列關于該反應的說法正確的是( )
A.最終可生成0.2 mol NH3
B.增大壓強能使反應速率減小
C.降低反應體系的溫度能加快反應速率
D.向容器中再加入N2,能加快反應速率
查看答案和解析>>
科目: 來源:2016-2017學年遼寧沈陽東北育才學校高二階段考一化學卷(解析版) 題型:選擇題
在體積為2L的密閉容器中充有2mol SO2和一定量的O2,發生反應2SO2+O2 2SO3.當反應進行到4min時,測得此時SO2為0.4mol,那么反應進行到2min時,密閉容器中SO2物質的量是( )
2SO3.當反應進行到4min時,測得此時SO2為0.4mol,那么反應進行到2min時,密閉容器中SO2物質的量是( )
A.小于1.2 mol B.1.2 mol C.大于1.6 mol D.1.6 mol
查看答案和解析>>
科目: 來源:2016-2017學年遼寧沈陽東北育才學校高二階段考一化學卷(解析版) 題型:選擇題
深海中存在可燃冰(CH4•nH2O固體).已知:CH4•nH2O(s)  CH4(g)+nH2O(l)﹣Q(Q>0)深海中能夠存在可燃冰,是因為深海具有以下條件中的( )
CH4(g)+nH2O(l)﹣Q(Q>0)深海中能夠存在可燃冰,是因為深海具有以下條件中的( )
A.低溫高壓 B.高溫低壓 C.低溫低壓 D.高溫高壓
查看答案和解析>>
科目: 來源:2016-2017學年遼寧沈陽東北育才學校高二階段考一化學卷(解析版) 題型:選擇題
在一個密閉容器中發生反應:2SO2(g)+O2(g) 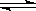 2SO3(g),反應過程中某一時刻SO2、O2、SO3的濃度分別為0.2 mol/L、0.2 mol/L、0.2 mol/L,當反應達到反應限度時可能的數據是( )
2SO3(g),反應過程中某一時刻SO2、O2、SO3的濃度分別為0.2 mol/L、0.2 mol/L、0.2 mol/L,當反應達到反應限度時可能的數據是( )
A.c(SO3)=0.4mol/L
B.c(SO2)=c(SO3)=0.15mol/L
C.c(O2)=0.35mol/L
D.c(SO2)+c(SO3)=0.4mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com