
��Ŀ�� ��Դ�� �}�ͣ�����}
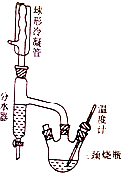 ������Ƃ������ѵ�ԭ�����£�
������Ƃ������ѵ�ԭ�����£�| ���| | �ܶ�/g•mL-1 | ���c/�� | ���c/�� | ˮ���� |
| ������ | 0.81 | -89.8 | 117.7 | ����ˮ |
| ������ | 0.769 | -98 | 142 | ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| ���| | Fe��OH��3 | Fe��OH��2 | Al��OH��3 |
| �_ʼ������pH | 1.9 | 7.0 | 3.4 |
| ��ȫ������pH | 3.2 | 9.0 | 4.7 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| 25�� | pH | 25�� | pH |
| �H2S��Һ | 3.9 | FeS�_ʼ���� | 3.0 |
| SnS������ȫ | 1.6 | FeS������ȫ | 5.5 |
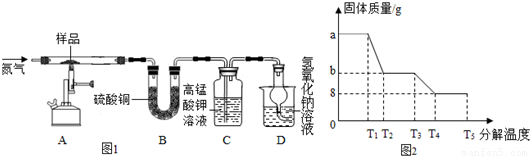
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}


�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| �ɷ� | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | ����������������| |
| �|���֔���%�� | 65��66 | 3.5��5.0 | 1.5��3.5 | 0.2��0.8 | 0.2��1.1 | 1.0��1.8 | 23-26 |

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
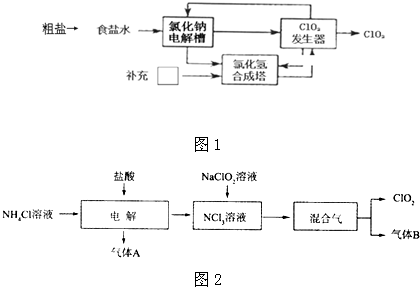
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| ���| | ���������|�� | �ܶ�/g•cm-3 | ���c/�� | ˮ���ܽ��� |
| ������ | 74 | 0.80 | 117.3 | �� |
| ���嶡�� | 137 | 1.27 | 101.6 | �y�� |
| �廯�� | 81 | --- | --- | �O���ܽ� |

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
����ʡ���W�`���Ͳ�����Ϣ�e��ƽ�_ | �W���к���Ϣ�e�^ | ����p�_�e�^ | ��vʷ̓�o���x�к���Ϣ�e�^ | �����֙��e�^
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com