
科目: 來源: 題型:解答題
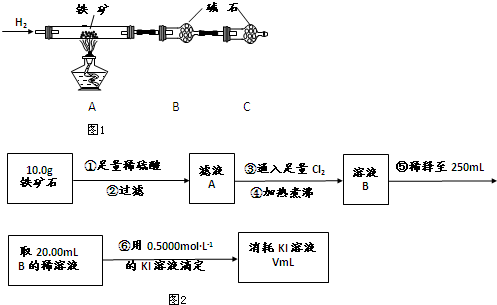
查看答案和解析>>
科目: 來源: 題型:解答題
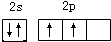 ;
;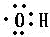 .
.| 容器 編號 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| Ⅱ | 387 | 0.80 | a | |
| Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
查看答案和解析>>
科目: 來源: 題型:解答題
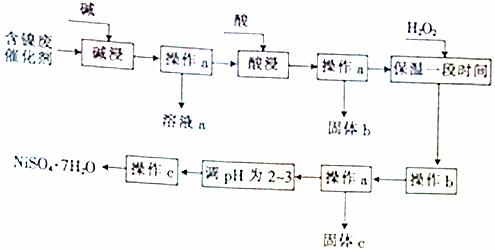
| 沉淀物 | 開始沉淀時的pH | 完全沉淀時的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目: 來源: 題型:解答題
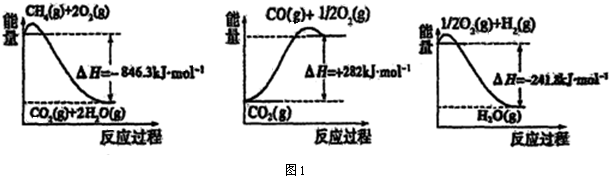
| 弱電解質 | H2CO3 | NH3•H2O |
| 電離平衡常數 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
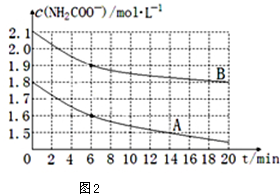
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 水玻璃可用于制備硅膠和木材防火劑 | |
| B. | 在現代化學工業中催化劑的應用十分普遍,對于給定條件下反應物之間能夠同時發生多個反應時,理想催化劑還可以大幅度提高目標產物在最終產物中的比率 | |
| C. | 煤經過氣化和液化兩個物理變化過程,可變為清潔能源 | |
| D. | PM2.5是指大氣中直徑小于或等于2.5微米的顆粒物,也稱為“細顆粒物”,PM2.5分散在空氣中可能形成膠體或濁液 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | N5+共有34個核外電子 | B. | N5+中氮原子間以共價鍵結合 | ||
| C. | 化合物N5ASF6中AS的化合價為+1價 | D. | 化合物N5ASF6中F的化合價為-1價 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目: 來源: 題型:解答題
 (1)某同學做如下實驗,以檢驗反應中的能量變化.
(1)某同學做如下實驗,以檢驗反應中的能量變化.查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 用鐵片和稀硫酸反應制氫氣時,改用98%的硫酸可以加快反應速率 | |
| B. | 100 mL 2 mol•L-1的鹽酸跟鋅片反應,加入適量的氯化鈉溶液,反應速率不變 | |
| C. | SO2的催化氧化反應是一個放熱的反應,所以升高溫度,反應速率變慢 | |
| D. | 汽車尾氣中的NO和CO可以緩慢反應生成N2和CO2,減小壓強反應速率變慢 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com