
科目: 來源: 題型:解答題
| 實驗組 | 溫度 | 起始時物質的量/mol | 平衡時物質的量/mol | 達到平衡所需的時間/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650℃ | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900℃ | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650℃ | 1.0 | 4.0 | 2.0 | a | b | c | t |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 肯定存在① | B. | 至少存在②和⑤ | C. | 無法確定是否有③ | D. | 至少存在①、④、⑤ |
查看答案和解析>>
科目: 來源: 題型:填空題
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸點/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目: 來源: 題型:填空題

查看答案和解析>>
科目: 來源: 題型:解答題
| 反應Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反應Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反應Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反應Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

查看答案和解析>>
科目: 來源: 題型:多選題
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有關粒子物質的量的變化如圖所示.下列有關說法正確的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有關粒子物質的量的變化如圖所示.下列有關說法正確的是| A. | H2A屬于強酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$隨著V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL時,溶液中存在關系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL時,溶液中存在關系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |
查看答案和解析>>
科目: 來源: 題型:解答題



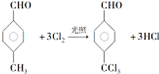 ,反應類型為取代反應
,反應類型為取代反應 +n
+n $\stackrel{催化劑}{→}$
$\stackrel{催化劑}{→}$ +(2n-1)H2O
+(2n-1)H2O 的路線流程圖:
的路線流程圖: 合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目: 來源: 題型:解答題
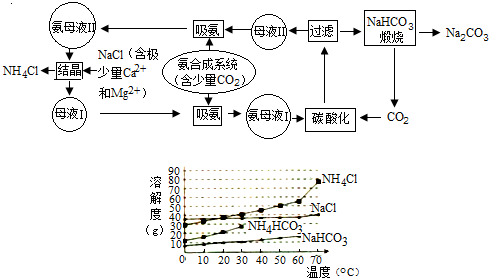
查看答案和解析>>
科目: 來源: 題型:填空題
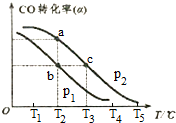
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol溫度升高,平衡向逆方向移動,進一步消耗了氫氣而生成了CO,使CO轉化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol溫度升高,平衡向逆方向移動,進一步消耗了氫氣而生成了CO,使CO轉化率更低.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com