
科目: 來源: 題型:選擇題
| A. | 用NaOH溶液滴定醋酸時,可用酚酞試液作指示劑 | |
| B. | 花生油、菜子油漕油等水解時可得到一種共同的產物 | |
| C. | NH3+HCl=NH4Cl能自發進行,其△H一定小于零 | |
| D. | 甲烷和氯氣反應與苯和硝酸反應的反應類型不同 |
查看答案和解析>>
科目: 來源: 題型:解答題
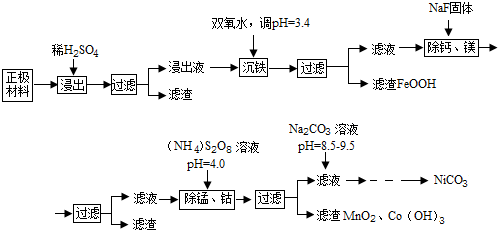
| 金屬離子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 濃度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 5種 | B. | 6種 | C. | 7種 | D. | 8種 |
查看答案和解析>>
科目: 來源: 題型:填空題
滴入高錳酸鉀溶液的次序(每滴溶液的體積相同) | 高錳酸鉀溶液紫色褪去的時間 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目: 來源: 題型:解答題
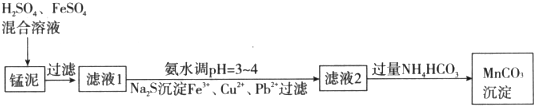
查看答案和解析>>
科目: 來源: 題型:解答題
| 滴定次數 | NaOH溶液體積/mL | 滴定消耗濾液體積/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
查看答案和解析>>
科目: 來源: 題型:解答題
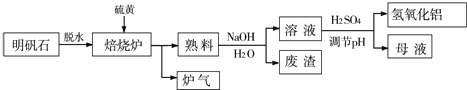
查看答案和解析>>
科目: 來源: 題型:多選題
| A. | 6種 | B. | 5種 | C. | 4種 | D. | 2種 |
查看答案和解析>>
科目: 來源: 題型:填空題
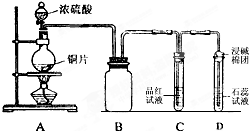 某同學為探究銅跟濃硫酸的反應情況,用如圖所示裝置進行了有關實驗.
某同學為探究銅跟濃硫酸的反應情況,用如圖所示裝置進行了有關實驗. .
.查看答案和解析>>
科目: 來源: 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com