
科目: 來源: 題型:實驗題
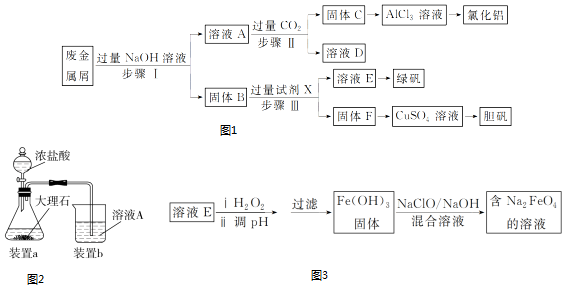
查看答案和解析>>
科目: 來源: 題型:實驗題
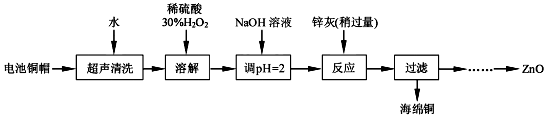
| Fe3+ | Fe2+ | Zn2+ | |
| 開始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目: 來源: 題型:實驗題
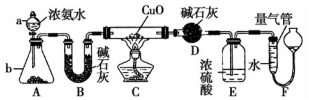 某課外活動小組欲利用CuO與NH4反應,研究NH3的某種性質并測定其組成,設計了如圖實驗裝置(夾持裝置未畫出)進行實驗.請回答下列問題:
某課外活動小組欲利用CuO與NH4反應,研究NH3的某種性質并測定其組成,設計了如圖實驗裝置(夾持裝置未畫出)進行實驗.請回答下列問題:查看答案和解析>>
科目: 來源: 題型:解答題
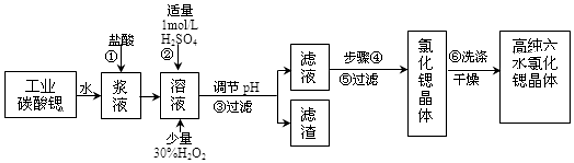
| 氫氧化物 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目: 來源: 題型:實驗題
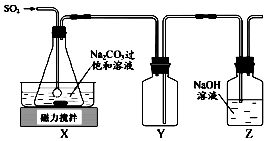 焦亞硫酸鈉(Na2S2O5)是常用的抗氧化劑,在空氣中,受熱時均易分解.實驗室制備少量Na2S2O5的方法:在不斷攪拌下,控制反應溫度在40℃左右,向Na2CO3過飽和溶液中通入SO2,實驗裝置如圖所示.
焦亞硫酸鈉(Na2S2O5)是常用的抗氧化劑,在空氣中,受熱時均易分解.實驗室制備少量Na2S2O5的方法:在不斷攪拌下,控制反應溫度在40℃左右,向Na2CO3過飽和溶液中通入SO2,實驗裝置如圖所示.查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 3種 | B. | 4種 | C. | 5種 | D. | 6種 |
查看答案和解析>>
科目: 來源: 題型:實驗題
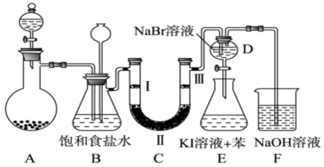
| a | b | c | d | |
| Ⅰ | 干燥的有色布條 | 干燥的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| Ⅱ | 堿石灰 | 硅膠 | 濃硫酸 | 無水氯化鈣 |
| Ⅲ | 濕潤的有色布條 | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
查看答案和解析>>
科目: 來源: 題型:解答題
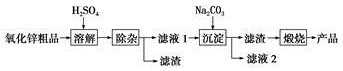
查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:解答題
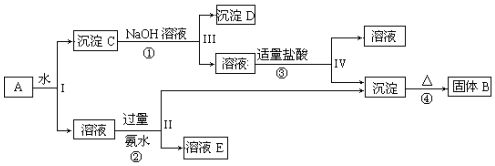
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com