
科目: 來源: 題型:實驗題
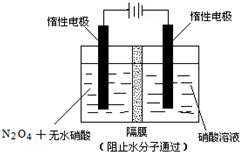 N2O5是一種新型硝化劑,其性質和制備受到人們的關注.
N2O5是一種新型硝化劑,其性質和制備受到人們的關注. .
.| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 時間(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
查看答案和解析>>
科目: 來源: 題型:填空題

查看答案和解析>>
科目: 來源: 題型:解答題
 150℃時,向如圖所示的容器(密封的隔板可自由滑動,整個過程中保持隔板上部壓強不變)中加入4LN2和H2的混合氣體,在催化劑作用下充分反應(催化劑體積忽略不計),反應后恢復到原溫度.平衡后容器體積變為3.4L,容器內氣體對相同條件的氫氣的相對密度為5.
150℃時,向如圖所示的容器(密封的隔板可自由滑動,整個過程中保持隔板上部壓強不變)中加入4LN2和H2的混合氣體,在催化劑作用下充分反應(催化劑體積忽略不計),反應后恢復到原溫度.平衡后容器體積變為3.4L,容器內氣體對相同條件的氫氣的相對密度為5.查看答案和解析>>
科目: 來源: 題型:實驗題
 煙氣的主要污染物是SO2、NOx,經臭氧預處理后再用適當溶液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:
煙氣的主要污染物是SO2、NOx,經臭氧預處理后再用適當溶液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:查看答案和解析>>
科目: 來源: 題型:多選題
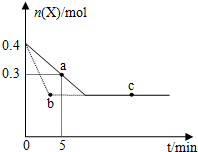
| A. | 虛線表示使用催化劑的情形 | |
| B. | b、c兩點表明反應在相應條件下達到了最大限度 | |
| C. | 反應進行到a點時放出的熱量大于反應進行到b點時放出的熱量 | |
| D. | 反應從開始到a點的平均反應速率可表示為v(Y)=0.01mol/(L•min) |
查看答案和解析>>
科目: 來源: 題型:解答題
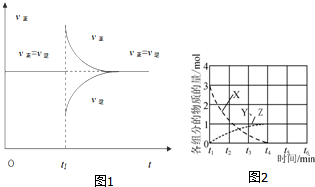
| 實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡 所需時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目: 來源: 題型:實驗題
 二甲醚又稱甲醚,簡稱DME,熔點-141.5℃,沸點-24.9℃,與石油液化氣(LPG)相似,被譽為“21世紀的清潔燃料”.制備原理如下:
二甲醚又稱甲醚,簡稱DME,熔點-141.5℃,沸點-24.9℃,與石油液化氣(LPG)相似,被譽為“21世紀的清潔燃料”.制備原理如下:| 化學鍵 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
查看答案和解析>>
科目: 來源: 題型:推斷題
查看答案和解析>>
科目: 來源: 題型:解答題
 氮的化合物在生產生活中廣泛存在.
氮的化合物在生產生活中廣泛存在. .可通過反應NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制備氯胺,已知部分化學鍵的鍵能如下表所示(假定不同物質中同種化學鍵的鍵能一樣),則上述反應的△H=+11.3kJ•mol-1.
.可通過反應NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制備氯胺,已知部分化學鍵的鍵能如下表所示(假定不同物質中同種化學鍵的鍵能一樣),則上述反應的△H=+11.3kJ•mol-1.| 化學鍵 | 鍵能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com