
科目: 來源: 題型:解答題
| 溫度/K | 反應I | 反應II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
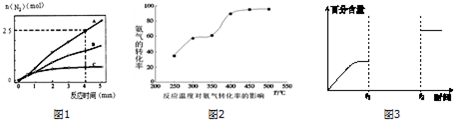
查看答案和解析>>
科目: 來源: 題型:實驗題
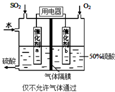 回答下列問題:
回答下列問題:查看答案和解析>>
科目: 來源: 題型:實驗題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:填空題
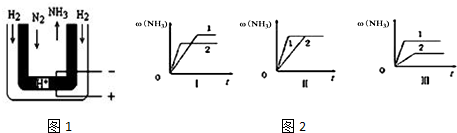
查看答案和解析>>
科目: 來源: 題型:實驗題
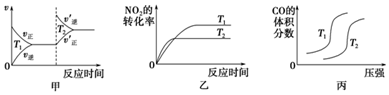
| 起始物質的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
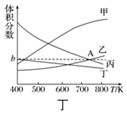
查看答案和解析>>
科目: 來源: 題型:實驗題
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
| 甲 | 乙 | 丙 | |
| 容積 | 1L | 1L | 0.5L |
| 起始加入物質 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡時 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃時該反應的平衡常數K為3.75 | |
| B. | 平衡時,X轉化率:甲<丙 | |
| C. | 若乙是絕熱容器,則平衡時,c(Z)>1.2mol•L-1 | |
| D. | 前2min內,丙容器中用X表示的平均反應速率v(X)=0.6mol•L-1 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 方法Ⅰ | 用炭粉在高溫條件下還原CuO |
| 方法Ⅱ | 電解法,反應為2Cu+H2O$\frac{\underline{\;電解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)還原新制Cu(OH)2 |
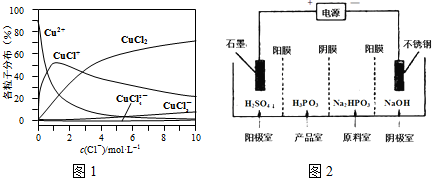
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com