
科目: 來源: 題型:填空題
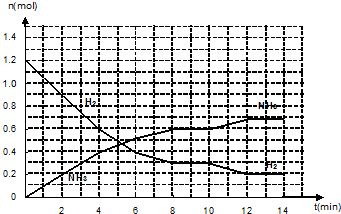
查看答案和解析>>
科目: 來源: 題型:選擇題
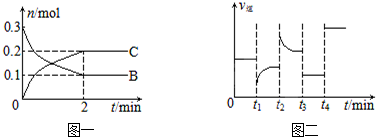
| A. | t2時改變的條件可能是增大c(C),平衡時B的物質的量分數增大 | |
| B. | t1時改變的條件是降溫,平衡逆向移動 | |
| C. | t3時可能是減小壓強,平衡不移動;t4時可能是使用催化劑,c(B)不變 | |
| D. | x=2,反應開始2 min內,v(B)=0.1 mol/(L•min) |
查看答案和解析>>
科目: 來源: 題型:填空題
| 容器 | 1 | 2 | 3 | 4 |
| 反應物投入量 (始態(tài)) | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH的平衡濃度/mol•L-1 | c1 | c2 | c3 | c4 |
| 反應的能量變化 | 放出 x kJ | 吸收y kJ | 吸收z kJ | 放出 w kJ |
| 體系壓強/Pa | p1 | p2 | p3 | p4 |
| 反應物轉化率 | a1 | a2 | a3 | a4 |
查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
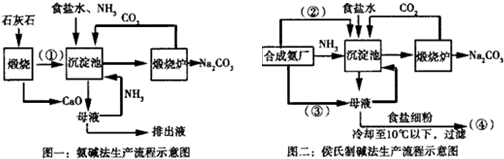
查看答案和解析>>
科目: 來源: 題型:解答題

| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| N(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
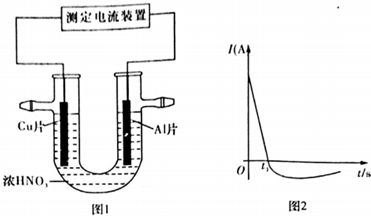
查看答案和解析>>
科目: 來源: 題型:解答題
| 溫度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目: 來源: 題型:填空題
| 物質 | CH3OH | CH3OCH3 | H2O |
| c/mol•L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目: 來源: 題型:填空題

查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com