
科目: 來源: 題型:選擇題
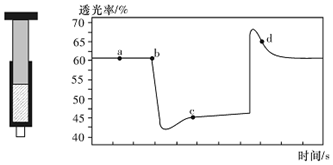
| A. | b點的操作是拉伸注射器 | |
| B. | d點:v(正)>v(逆) | |
| C. | c點與a點相比,c(N02)增大,c(N204)減小,若容器絕熱則平衡常數Ka>Kc | |
| D. | 若不忽略體系溫度變化,且沒有能量損失,則T(b)<T(c) |
查看答案和解析>>
科目: 來源: 題型:解答題
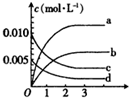 在2L密閉容器內,80℃時反應:2NO(g)+O2(g)?2NO2(g),反應體系中,n(NO)隨時間t的變化如表
在2L密閉容器內,80℃時反應:2NO(g)+O2(g)?2NO2(g),反應體系中,n(NO)隨時間t的變化如表| 時間t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
| 化學鍵 | H-H | N-H | N≡N |
| 鍵能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| -c(NO)/mol•L -1 | 1.00×10 -3 | 4.50×10-4 | 2.50×10 -4 | 1.50×10 -4 | 1.00×10 -4 | 1.00×10 -4 |
| -c(CO)/mol•L-1 | 3.60×10 -3 | 3.05×10 -3 | 2.85×10 -3 | 2.75×10 -3 | 2.70×10 -3 | 2.70×10-3 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| 反應 | △H(kJ•mol-1) | 平衡常數K |
| ①4NH3(g)+5O2(g)?4NO(g)+6H2O(g) | -907 | 1.1×1026 |
| ②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g) | -1105 | 4.4×1028 |
| ③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g) | -1269 | 7.1×1034 |
| A. | N2(g)+O2(g)=2NO(g)△H=362 kJ•mol-1 | |
| B. | 增大壓強,則反應②的K 不變,反應①和③的K 減小 | |
| C. | 500℃,2N2O(g)+O2(g)═4 NO(g) K=400 | |
| D. | 使用合適的催化劑可提高反應的選擇性,提高NO 的產出率 |
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:選擇題
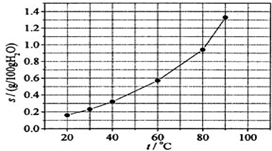
| A. | 溫度升高時溴酸銀溶解速度加快 | |
| B. | 若硝酸鉀中含有少量溴酸銀,可用重結晶方法提純 | |
| C. | 60℃時溴酸銀的Ksp約等于6×10-4 | |
| D. | 溴酸銀的溶解是放熱過程 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 滴加過程中,當溶液的pH=7時,溶液中2c(NH4+)=c(SO42-) | |
| B. | 滴加過程中,當溶液中c(Cu2+)=2.2×10-2 mol/L時,溶液的pH=9 | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀時消耗溶液的體積小于V | |
| D. | 若將氨水加水稀釋,則稀釋過程中,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始終保持增大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com