
科目: 來源: 題型:解答題
| 滴定次數 | 待測液體積 (mL) | 標準KMnO4溶液體積(mL) | |
| 滴定前讀數 | 滴定后讀數 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 滴定次數 | 待測NaOH溶液的體積/mL | 0.100 0mol•L-1鹽酸的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 此沉淀是Mg(OH)2、Ca(OH)2的混合物 | |
| B. | 此沉淀只有Mg(OH)2 | |
| C. | 過濾后濾液中存在Ca2+、Mg2+ | |
| D. | 向原溶液中加入8.8 g NaOH固體,不可以使Ca2+部分轉化為沉淀 |
查看答案和解析>>
科目: 來源: 題型:解答題
 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸鈉(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸鈉(Na5P3O10).| 滴定次數 | 待測溶液A的體積(/mL) | 0.1000mol•L-1NaOH溶液的體積 | |
| 滴定前讀數(/mL) | 滴定后讀數(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目: 來源: 題型:填空題
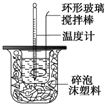
| 溫度 實驗次數 | 起始溫度t1/℃ | 終止溫 度t2/℃ | 平均溫度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 25℃時,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS飽和溶液中加入少量NazS固體,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工業廢水中的Cu2+,可用FeS作為沉淀劑 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,濃度均為0.010 moI•L-1.向該溶液中逐滴加入0.010 mol•L-1的Na2S溶液時,Fe2+最先沉淀出來 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 步驟①中加酸,將溶液的pH 調節至2,溶液顯黃色,CrO42-離子濃度增大 | |
| B. | 步驟①中當溶液呈現深黃色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)時,說明反應2CrO42-(黃色)+2H+?Cr2O72-(橙色)+H2O 達到平衡狀態 | |
| C. | 步驟②中,若要還原1 mol Cr2O${\;}_{7}^{2-}$離子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步驟③中,當將溶液的pH 調節至4 時,可認為廢水中的鉻元素已基本除盡 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | A | |
| B. | B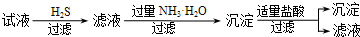 | |
| C. | C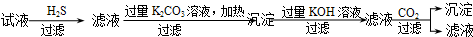 | |
| D. | D |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 向AgI中加一定濃度、一定體積的NaCl溶液,AgI可轉化為AgCl | |
| B. | 常溫下,AgCl若要在NaI溶液中開始轉化為AgI,則NaI的濃度應該大于$\frac{1}{\sqrt{1.8}}$×10-11mol/L | |
| C. | AgI比AgCl更難溶于水,AgCl可以轉化為AgI | |
| D. | 向c(Ag+)=1.8×10-4mol/L的溶液中加入等體積NaCl溶液,開始出現AgCl沉淀,則NaCl溶液濃度應大于1.0×10-6mol/L |
查看答案和解析>>
科目: 來源: 題型:解答題
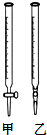
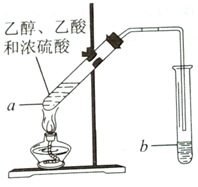 紅葡萄酒密封儲存時間越長,質量越好,原因之一是儲存過程中生成了香味的酯.在實驗室可以用如圖所示的裝置制取乙酸乙酯,請回答下列問題.
紅葡萄酒密封儲存時間越長,質量越好,原因之一是儲存過程中生成了香味的酯.在實驗室可以用如圖所示的裝置制取乙酸乙酯,請回答下列問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com