
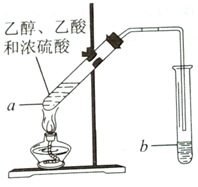
 紅葡萄酒密封儲存時間越長,質量越好,原因之一是儲存過程中生成了香味的酯.在實驗室可以用如圖所示的裝置制取乙酸乙酯,請回答下列問題.
紅葡萄酒密封儲存時間越長,質量越好,原因之一是儲存過程中生成了香味的酯.在實驗室可以用如圖所示的裝置制取乙酸乙酯,請回答下列問題.分析 (1)乙醛分子中含有醛基;
(2)乙酸、乙醇在濃硫酸作用下發生酯化反應生成乙酸乙酯和水;
(3)濃硫酸起到了催化作用和吸水作用;
(4)試管b中加碳酸鈉溶液,吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,偏于分層;
(5)乙酸乙酯難溶于飽和Na2CO3溶液,而且密度比水小.
解答 解:(1)乙醛分子中含有醛基,其結構簡式為CH3CHO;
故答案為:CH3CHO;
(2)a中乙酸、乙醇在濃硫酸作用下發生酯化反應生成乙酸乙酯和水,則反應為CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O,該反應屬于取代反應;
故答案為:CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O;取代反應;
(3)乙酸與乙醇發生酯化反應,需濃硫酸作催化劑,該反應為可逆反應,濃硫酸吸水利于平衡向生成乙酸乙酯方向移動,濃硫酸的作用為催化劑,吸水劑,
故答案為:催化劑、吸水劑;
(4)加碳酸鈉溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,偏于分層,則反應開始前,試管b中盛放的溶液是飽和碳酸鈉溶液,
故答案為:飽和碳酸鈉溶液;
(5)乙酸乙酯難溶于飽和Na2CO3溶液,而且密度比水小,所以乙酸乙酯和碳酸鈉溶液在一起會分為上下兩層,可以用分液法分離;
故答案為:分液.
點評 本題考查有機物的制備實驗,把握有機物的結構與性質、有機反應為解答的關鍵,側重分析與實驗能力的考查,注意混合物分離的應用,題目難度不大.


 陽光試卷單元測試卷系列答案
陽光試卷單元測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | X>Y>Z | B. | X>Z>Y | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3種 | B. | 4種 | C. | 5種 | D. | 6種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深.
在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 溫度 實驗次數 | 起始溫度t1/℃ | 終止溫 度t2/℃ | 平均溫度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在一定溫度下AgCl水溶液中,Ag+和Cl-濃度的乘積是一個常數 | |
| B. | AgCl的Ksp=1.8×10-10 mol2•L-2,在任何含AgCl固體的溶液中,c(Ag+)=c(Cl-)且Ag+與Cl-濃度的乘積等于1.8×10-10 mol2•L-2 | |
| C. | 溫度一定時,當溶液中Ag+和Cl-濃度的乘積等于Ksp值時,此溶液為AgCl的飽和溶液 | |
| D. | 向2.0mL濃度均為0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1 AgNO3溶液,振蕩,沉淀呈黃色,說明AgCl的Ksp比AgI的Ksp小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com