
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
| 溫度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
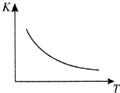 工業上制備H2的一種重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知該反應的平衡常數K與溫度T的關系如圖所示.若在一固定的密閉容器中,850℃時發生上述反應,測得容器內各物質的濃度 (mol/L)隨時間的變化關系如下表:
工業上制備H2的一種重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知該反應的平衡常數K與溫度T的關系如圖所示.若在一固定的密閉容器中,850℃時發生上述反應,測得容器內各物質的濃度 (mol/L)隨時間的變化關系如下表:| 時間/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
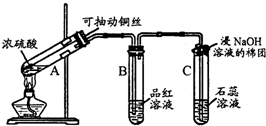
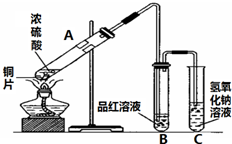 圖是進行銅與濃硫酸反應并進行產物檢驗的裝置.
圖是進行銅與濃硫酸反應并進行產物檢驗的裝置.查看答案和解析>>
科目: 來源: 題型:解答題
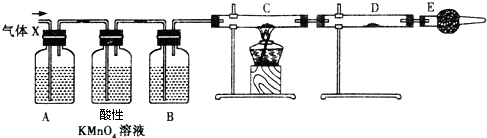
查看答案和解析>>
科目: 來源: 題型:解答題
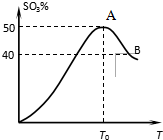 在體積為2L密閉 絕熱容器中,將物質的量均為2.00mol的SO2、O2混合,發生如下反應:2SO2(g)+O2(g)?2SO3(g),容器中SO3的體積分數
在體積為2L密閉 絕熱容器中,將物質的量均為2.00mol的SO2、O2混合,發生如下反應:2SO2(g)+O2(g)?2SO3(g),容器中SO3的體積分數 查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com