
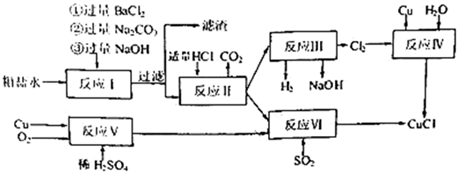
分析 由流程分析,粗鹽水加入過量氯化鋇沉淀硫酸根離子,加入過量氫氧化鈉沉淀鎂離子,最后加入碳酸鈉沉淀過量的鋇離子、鈣離子,過濾后加入鹽酸除去過量的碳酸鈉,得到較純凈的氯化鈉溶液,電解得到氫氧化鈉溶液,氫氣和氯氣,利用生成的氯氣和過量銅反應生成氯化亞銅;也可以利用銅、氧氣、稀硫酸反應生成硫酸銅通入二氧化硫還原得到氯化亞銅,
(1)粗鹽提純中加入氯化鋇溶液時沉淀硫酸根離子,步驟①②不能交換,否則加入過量的氯化鋇溶液中鋇離子不能除去;
(2)煅燒硫鐵礦制取二氧化硫,二硫化亞鐵和氧氣反應生成氧化鐵和二氧化硫,工業制備硫酸的過程中將二氧化硫轉變為三氧化硫的設備名稱為接觸室;
(3)依據流程分析反應Ⅴ是銅和氧氣,稀硫酸反應生成硫酸銅和水;
(4)二氧化硫和硫酸銅之間可以發生氧化還原反應生成氯化亞銅沉淀;
(5)乙醇和水易揮發,CuCl具有還原性,可以被空氣氧化;
(6)依據反應過程中銅元素守恒計算.
解答 解:(1)反應I中加BaCl2溶液的作用是沉淀硫酸根離子,步驟①②不能交換,原因是過量的Ba2+無法除去,
故答案為:沉淀硫酸根離子;過量的Ba2+無法除去;
(2)煅燒硫鐵礦制取二氧化硫,二硫化亞鐵和氧氣反應生成氧化鐵和二氧化硫,反應的化學方程式為:4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2,工業制備硫酸的過程中將二氧化硫轉變為三氧化硫的設備名稱為接觸室,
故答案為:4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2;接觸室;
(3)流程分析反應Ⅴ是銅和氧氣,稀硫酸反應生成硫酸銅和水,反應的化學方程式為:2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案為:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(4)二氧化硫和硫酸銅之間可以發生氧化還原反應生成氯化亞銅沉淀,即2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4,反應的離子方程式為:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-,
故答案為:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-;
(5)CuCl沉淀,用無水乙醇洗滌沉淀,在真空干燥機內于70℃干燥2小時,這樣可以加快乙醇和水的蒸發,防止CuCl被空氣氧化,
故答案為:加快乙醇和水的蒸發,防止CuCl被空氣氧化;
(6)2Cu+O2+2H2SO4=2CuSO4+2H2O,2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-,反應過程中依據銅元素守恒計算,320g銅經反應V和反應VI制CuCl,若反應V中銅的轉化率為90%,反應VI中硫酸銅的損失率為5%,可得到95%的CuCl的質量=$\frac{320g×90%×(1-5%)}{64g/mol×95%}×99.5g/mol$=447.75g,
故答案為:447.75g.
點評 本題涉及物質的分離和提純的方法以及操作、化學方程式書寫與技術等方面的知識,注意知識的遷移和應用是解題的關鍵,題目難度中等.


 芝麻開花課程新體驗系列答案
芝麻開花課程新體驗系列答案科目:高中化學 來源:2017屆吉林省高三上第二次模擬化學試卷(解析版) 題型:選擇題
對相同狀況下的12C18O和14N2兩種氣體,下列說法正確的是
A. 若質量相等,則質子數相等 B. 若原子數相等,則中子數相等
C. 若分子數相等,則體積相等 D. 若體積相等,則密度相等
查看答案和解析>>
科目:高中化學 來源:2016-2017學年云南省高一9月月考化學卷(解析版) 題型:選擇題
下列水溶液中的各組離子因為發生氧化還原反應而不能大量共存的是
A.Na+、Ba2+、Cl?、SO42-
B.Ca2+、HCO3?、C1?、K+
C.MnO4?、K+、I?、H+
D.H+ 、Cl? 、Na+ 、CO32?
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
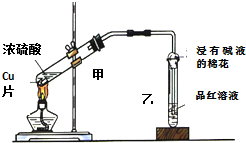 用如圖裝置做濃硫酸和銅反應的實驗,實驗過程中觀察到甲試管底部有一些白色固體,乙試管中品紅溶液褪色.
用如圖裝置做濃硫酸和銅反應的實驗,實驗過程中觀察到甲試管底部有一些白色固體,乙試管中品紅溶液褪色.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
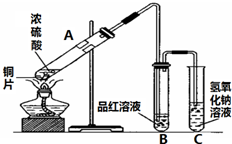 圖是進行銅與濃硫酸反應并進行產物檢驗的裝置.
圖是進行銅與濃硫酸反應并進行產物檢驗的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮化鋁(AlN)是一種人工合成的非氧化物陶瓷材料,可在溫度高于1500℃時,通過碳熱還原法制得.實驗研究認為,該碳熱還原反應分兩步進行:
氮化鋁(AlN)是一種人工合成的非氧化物陶瓷材料,可在溫度高于1500℃時,通過碳熱還原法制得.實驗研究認為,該碳熱還原反應分兩步進行:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
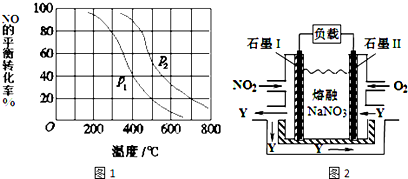
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
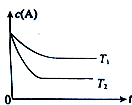 運用所學知識,解決下列問題:
運用所學知識,解決下列問題:
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A是固體,C是氣體,正反應吸熱 | B. | A是氣體,C是氣體,正反應放熱 | ||
| C. | A是氣體,C是固體,正反應放熱 | D. | A是氣體,C是氣體,正反應吸熱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com