
科目: 來源: 題型:解答題
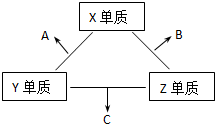 X、Y、Z三種短周期元素,它們的原子序數之和為16.X、Y、Z三種元素的常見單質在常溫下都是無色氣體,在適當條件下可發生如下變化:
X、Y、Z三種短周期元素,它們的原子序數之和為16.X、Y、Z三種元素的常見單質在常溫下都是無色氣體,在適當條件下可發生如下變化: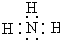 ,C分子的結構呈三角錐形.
,C分子的結構呈三角錐形.查看答案和解析>>
科目: 來源: 題型:解答題
 鉻、鐵、鎳、銅等金屬及其化合物在工業上有重要用途.
鉻、鐵、鎳、銅等金屬及其化合物在工業上有重要用途.查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | Al4C3晶體,熔點2200℃,熔融態不導電 | |
| B. | C3N4晶體具有比金剛石還大的硬度 | |
| C. | VF5晶體易溶于一些有機溶劑中 | |
| D. | BaCl2熔融狀態下能夠導電 |
查看答案和解析>>
科目: 來源: 題型:解答題
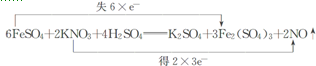 .
.查看答案和解析>>
科目: 來源: 題型:推斷題
 .
.查看答案和解析>>
科目: 來源: 題型:解答題
 有A、B、C、D、E是前四期的元素,其中A元素和B元素的原子都有1個未成對電子,A+比B-少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子有3能級,且有3個未成對電子;D的最外層電子數是內層電子數的3倍.基態的E是前四周期中未成對電子數最多的原子.
有A、B、C、D、E是前四期的元素,其中A元素和B元素的原子都有1個未成對電子,A+比B-少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子有3能級,且有3個未成對電子;D的最外層電子數是內層電子數的3倍.基態的E是前四周期中未成對電子數最多的原子.查看答案和解析>>
科目: 來源: 題型:解答題
 ,丙的電子式為
,丙的電子式為 ;E在周期表中的位置為第三周期VA族;
;E在周期表中的位置為第三周期VA族;查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:實驗題
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目: 來源: 題型:解答題
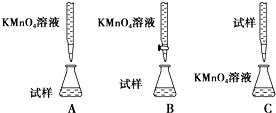
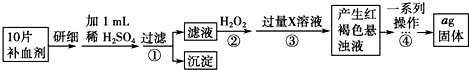
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com