
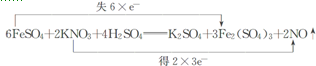 .
.分析 (1)判斷化合價降低的反應物是氧化劑、化合價升高的反應物是還原劑,根據氧化劑得到的電子等于還原劑失去的電子來求x和y;
(2)根據化合價升降總數相等和質量守恒來配平方程式;
(3)根據化合價升高的反應物是還原劑,其對應產物為氧化產物;
(4)雙線橋的箭頭始于反應物有關元素的原子或離子,箭頭指向發生化合價變化后生成物中對應元素的原子或離子或原子團,要標明電子的得失字樣及得失電子數目;
(5)摩爾質量以g/mol作單位,數值上等于其相對分子質量;
根據n=$\frac{m}{M}$計算氨氣的物質的量,根據N=nNA計算氨氣分子數目,結合氨氣分子含有的H原子數目計算氫原子物質的量;
根據n=$\frac{m}{M}$計算二氧化碳的物質的量,再根據m=nM計算氧氣的質量.
解答 解:(1)n(FeSO4)=11.4g/152g•mol-1=0.075mol,KNO3的物質的量為0.05L×0.5mol•L-1=0.025mol,設NO3-與NxOy中N元素化合價差為a,根據得失電子總數相等的原則,可得關系式:0.075×1=0.025×a,所以a=3即NxOy中N元素化合價為+2價,NxOy為NO,所以x=y=1,
故答案為:1;1;
(2)FeSO4中鐵的化合價由+2價升高為+3價,變化1,KNO3中氮的化合價由+5價降低為+2價,變化3,化合價升降總數相等和質量守恒來配平方程式:6FeSO4+2KNO3+4H2SO4=3Fe2(SO4)3+K2SO4+2NO↑+4H2O,
故答案為:6;2;4;3;1;2;4;
(3)FeSO4中鐵的化合價由+2價升高為+3價,是還原劑,所以對應的產物Fe2(SO4)3是氧化產物,
故答案為:Fe2(SO4)3;
(4)雙線橋的箭頭始于反應物有關元素的原子或離子,箭頭指向發生化合價變化后生成物中對應元素的原子或離子或原子團,要標明電子的得失字樣及得失電子數目,此反應用雙線橋法表示如下: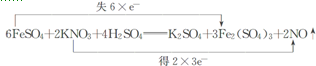 ,
,
故答案為: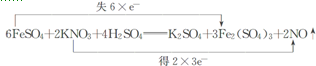 ;
;
(5)硝酸的摩爾質量為63g/mol;
3.4g氨氣的物質的量=$\frac{3.4g}{17g/mol}$=0.2mol,
含有分子數目=0.2mol×NAmol-1=0.2NA,
含有H原子物質的量=0.2mol×3=0.6mol;
標況下,4.48L CO2的物質的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,
與其等物質的量的氧氣的質量=0.2mol×32g/mol=6.4g,
故答案為:43g/mol;0.2;0.2NA;0.6;6.4.
點評 本題主要考查了氧化還原反應的配平、氧化產物的判斷及分析氧化還原反應用,題目難度中等,注意基礎知識的掌握,明確元素的化合價變化來分析是解答本題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 四個C-H鍵完全相同 | B. | CH4的一氯代物只有一種 | ||
| C. | CH2Cl2只有一種空間結構 | D. | 在常溫常壓下CH2Cl2為液體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{9a}$ mol-1 | B. | 9a mol-1 | C. | 2a mol-1 | D. | 18a mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14.2g | B. | 7.3g | C. | 3.65g | D. | 7.1g |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
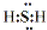 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
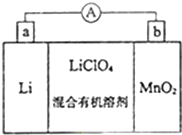 鋰錳電池的體積小,性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4溶于混合有機溶劑中,Li+ 通過電解質遷移入MnO2晶格中,生成LiMnO2.回答下列問題:
鋰錳電池的體積小,性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4溶于混合有機溶劑中,Li+ 通過電解質遷移入MnO2晶格中,生成LiMnO2.回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com