
科目: 來源: 題型:解答題
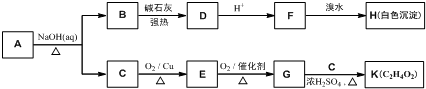

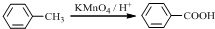
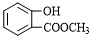 .
.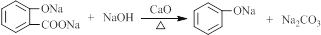 .
.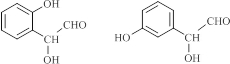 (寫結構簡式).
(寫結構簡式).查看答案和解析>>
科目: 來源: 題型:解答題
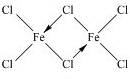 ,你認為該分子是否為平面形分子?否(填“是”或“否”).
,你認為該分子是否為平面形分子?否(填“是”或“否”).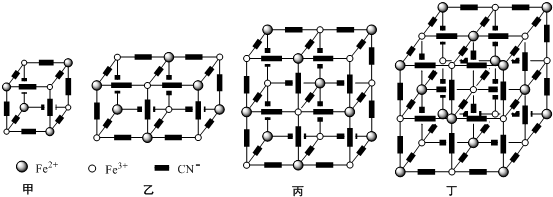
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
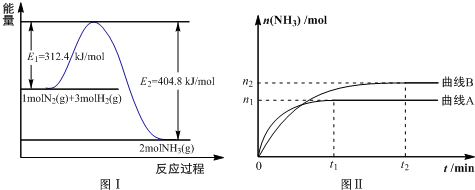
科目: 來源: 題型:解答題
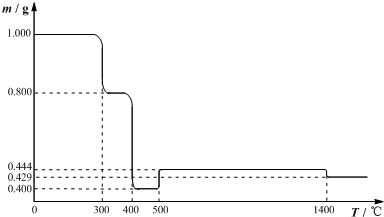
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | Y、Z兩元素形成的簡單陰離子的還原性Z>Y | |
| B. | 原子半徑大小的順序為Z>X>Y>W | |
| C. | X與W形成的化合物W2X2中含有離子鍵和共價鍵 | |
| D. | Y、Z兩種元素最高價氧化物的水化物的酸性Z>Y |
查看答案和解析>>
科目: 來源: 題型:選擇題
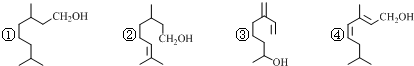
| A. | ①③④互為同分異構體 | |
| B. | ②③④互為同系物 | |
| C. | 上述四種物質中能使酸性KMnO4溶液褪色的只有②③④ | |
| D. | 上述物質分別與足量H2發生加成反應,共可得2種產物 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 4 g重水中所含質子數為2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反應中,每生成32g氧氣,則轉移2NA個電子 | |
| C. | 銅與足量濃硫酸共熱放出4.48 LSO2時,消耗的銅原子數為0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有銅原子數為0.1NA |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | “靜電除塵”、“汽車尾氣的催化凈化”都有利于提高空氣質量 | |
| B. | 減少化石燃料的使用,有利于降低空氣中PM2.5的含量 | |
| C. | 食品包裝袋中常放入小袋的生石灰,目的是防止食品氧化變質 | |
| D. | 醫用酒精是用淀粉類植物發酵經蒸餾制成,濃度通常是75% |
查看答案和解析>>
科目: 來源: 題型:解答題
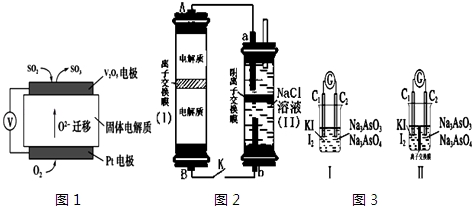
查看答案和解析>>
科目: 來源: 題型:解答題
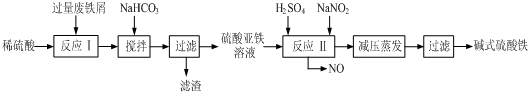
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com