
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(實驗班)化學試卷(解析版) 題型:選擇題
某一可逆反應的反應物和生成物都是氣體,改變下列條件一定能使化學平衡向正反應方向移動的是
A.恒壓下充入稀有氣體 B.減小反應容器的體積
C.升高反應溫度 D.分離出生成物
查看答案和解析>>
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(實驗班)化學試卷(解析版) 題型:選擇題
常溫下,下列四種溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。有關上述溶液的比較中,正確的是
A.將等體積的①、②溶液混合后,鹽酸會抑制醋酸的電離,所以pH﹥2
B.將一定體積的②、③溶液混合后, 溶液顯堿性,則該混合溶液中c(Cl-)﹥c(NH4+)
溶液顯堿性,則該混合溶液中c(Cl-)﹥c(NH4+)
C.將一定體積的①、④溶液混合后,溶液顯酸性,則V(NaOH)可能等于V(CH3COOH)
D.向等體積的③、④溶液中加水稀釋10倍,稀釋后溶液中由 水電離的c(H+):③﹥④
水電離的c(H+):③﹥④
查看答案和解析>>
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(實驗班)化學試卷(解析版) 題型:選擇題
已知部分弱酸的電離平衡常數如下表:

下列離子方程式正確的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO 3溶液中:SO2+H2O+2 CO
3溶液中:SO2+H2O+2 CO =SO
=SO +2HCO3-
+2HCO3-
D.相同濃度NaHCO3溶液與NaHSO3溶液等體積混合:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(實驗班)化學試卷(解析版) 題型:填空題
二甲醚是一種重要的化工原料,利用水煤氣(CO、H2)合成二甲醚是工業(yè)上的常用方法,該方法由以下幾步組成:
2H2(g)+CO(g)  CH3OH(g) ΔH= —90.0 kJ·mol-1 ①
CH3OH(g) ΔH= —90.0 kJ·mol-1 ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= —24.5 kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH= —24.5 kJ·mol-1 ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH= —
CO2(g)+H2(g) ΔH= — 41.1 kJ·mol-1 ③
41.1 kJ·mol-1 ③
(1)反應①的ΔS 0(填“>”、“<”或“=”)。在 (填“較高”或“較低”)溫度下該反應自發(fā)進行。
(2)在250℃的恒容密閉容器中,下列事實可以作為反應③已達平衡的是 (填選項字母)。
A.容器內氣體密度保持不變 B.CO與CO2的物質的量之比保持不變
C.H2O與CO2的生成速率之比為1∶1 D.該反應的平衡常數保持不變
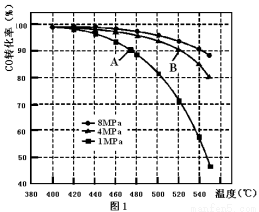
(3)當合成氣中CO與H2的物質的量之比恒定時,溫度、壓強對CO轉化率的影響如圖1所示。圖1中A點的v(逆) B點的v(正)(填“>”、“<”或“=”),說明理由 。實際工業(yè)生產中該合成反應的條件為500℃、4MPa請回答采用500℃的可能原因 。
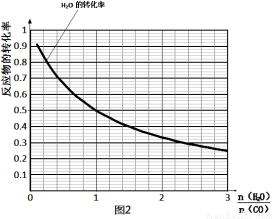
(4)一定溫度下,密閉容器中發(fā)生反應③,水 蒸氣的轉化率與n(H2O)∕n(CO)的關系如圖:計算該溫度下反應③的平衡常數K= 。在圖2中作出一氧化碳的轉化率與n(H2O)∕n(CO)的曲線。
蒸氣的轉化率與n(H2O)∕n(CO)的關系如圖:計算該溫度下反應③的平衡常數K= 。在圖2中作出一氧化碳的轉化率與n(H2O)∕n(CO)的曲線。
查看答案和解析>>
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(實驗班)化學試卷(解析版) 題型:實驗題
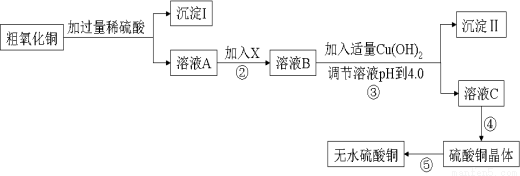
某化學活動小組按下圖所示流程由粗氧化銅樣品(含少量氧化亞鐵及不溶于酸的雜質)制取無水硫酸銅。
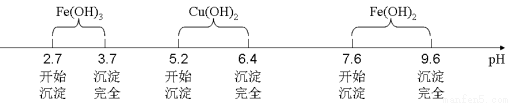
已知Fe3+、Cu2+、Fe2+三種離子在水溶液中形成氫氧化物沉淀的pH范圍如下圖所示:
請回答下列問題:
(1)在整個實驗過程中,下列實驗裝置不可能用到的是 (填序號)
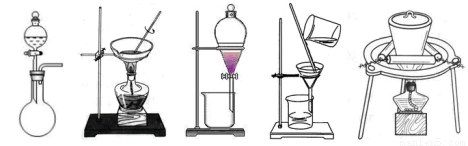
① ② ③ ④ ⑤
(2)溶液A中所含溶質為 ;
(3)物質X應選用 (填序號),沉淀II的主要成分是
①氯水 ②雙氧水 ③鐵粉 ④高錳酸鉀
(4)從溶液C中制取硫酸銅晶體的實驗操作為 。
(5)用“間接碘量法”可以測定溶液A中Cu2+(不含能與I-發(fā)生反應的雜質)的濃度。過程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL。
第二步:取稀釋后試液20.00mL于錐形瓶中,加入過量KI固體,充分反應生成白色沉淀與碘單質。
第三步:以淀粉溶液為指示劑,用0.05000mol·L-1的Na2S2O3標準溶液滴定,前后共測定三組。達到滴定終點時,消耗Na2S2O3標準溶液的體積如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
滴定次數 | 第一次 | 第二次 | 第三次 |
滴定前讀數(mL) | 0.10 | 0.36 | 1.10 |
滴定滴定后讀數(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液與KI的反應的離子方程式為 。
②滴定中,試液Na2S2O3應放在  (填“酸式滴定管”或“堿式滴定管”),判斷滴定終點的依據是 。
(填“酸式滴定管”或“堿式滴定管”),判斷滴定終點的依據是 。
③溶液A中c(Cu2+)= mol·L-1
查看答案和解析>>
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(普通班)化學試卷(解析版) 題型:選擇題
已知:CH3CH2CH2CH3(g)+13/2O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ/m ol
ol
(CH3)2CHCH3(g)+13/2O2(g)===4CO2(g)+5H2O(l) ΔH=-2 869 kJ/mol
下列說法正確的是
A.正丁烷分子儲存的能量大于異丁烷分子
B.正丁烷的穩(wěn)定性大于異丁烷
C.異丁烷轉化為正丁烷的過程是一個放熱過程
D.異丁烷分子中的碳氫鍵比正丁烷的多
查看答案和解析>>
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(普通班)化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.氯化鈉固體不導電,所以氯化鈉是非電解質
B.向純水中加入碳酸鈉能使水的電離平衡正向移動,水的離子積增大
C.如圖研究的是鐵的吸氧腐蝕,實驗中紅色首先在食鹽水滴的中心出現
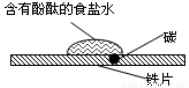
D.常溫下,反應4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) 的△H<0 △S<0
查看答案和解析>>
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(普通班)化學試卷(解析版) 題型:選擇題
為探究足量鋅與稀硫酸的反應速率(以v(H2)表示),向反應混合液中加入某些物質,下列判斷正確的是
A.加入NH4HSO4固體,v(H2)不變,生成H2量不變
B.加入少量水,v(H2)減小,生成H2量減少
C.加入CH3COONa固體,v(H2)減小,生成H2量不變
D.滴加少量CuSO4溶液,v(H2)增大,生成H2量減少
查看答案和解析>>
科目: 來源:2015-2016學年浙江省桐鄉(xiāng)市高二上期中(普通班)化學試卷(解析版) 題型:選擇題
己知N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列結論正確的是
2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列結論正確的是
A.在密閉容 器中加入1mol N2和3mol H2充分反應放熱92.4kJ
器中加入1mol N2和3mol H2充分反應放熱92.4kJ
B.N2(g)+3H2(g) 2NH3(l)△H=﹣QkJ•mo1﹣1,則Q>92.4
2NH3(l)△H=﹣QkJ•mo1﹣1,則Q>92.4
C.增大壓強,平衡向右移動,平衡常數增大
D.若一定條件下反應達到平衡,N2的轉化率為20%,則H2的轉化率為60%
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com