
科目: 來源: 題型:
| ||
查看答案和解析>>
科目: 來源: 題型:
| 干法 | Fe2O3、KNO3、KOH混合加熱共熔生成紫紅色K2FeO4和KNO2等產物 |
| 濕法 | 強堿性介質中,Fe(NO3)3與NaClO反應生成紫紅色Na2FeO4溶液 |
| ||
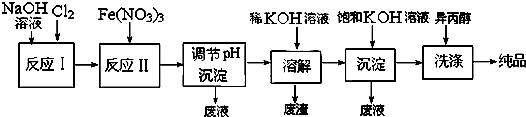
查看答案和解析>>
科目: 來源: 題型:
 科學家一直致力于“人工固氮”的方法研究.合成氨的原理為:N2(g)+3H2(g)?2NH3(g),該反應的能量變化如圖所示.
科學家一直致力于“人工固氮”的方法研究.合成氨的原理為:N2(g)+3H2(g)?2NH3(g),該反應的能量變化如圖所示.查看答案和解析>>
科目: 來源: 題型:
| 實驗序號 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的體積/mL | 5.0 | 10.0 | 15.0 |
| 生成氣體的體積/mL(標準狀況) | 44.8 | 89.6 | 112 |
查看答案和解析>>
科目: 來源: 題型:
| CH4 | C2H6 | CO32- | C2O42- | ||
| NH4+ | N2H62+ | NO2+ | N2O4 |
查看答案和解析>>
科目: 來源: 題型:
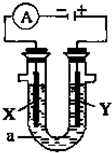 (1)事實證明,能設計成原電池的反應通常是放熱反應,下列化學反應在理論上可以設計成原電池的是
(1)事實證明,能設計成原電池的反應通常是放熱反應,下列化學反應在理論上可以設計成原電池的是查看答案和解析>>
科目: 來源: 題型:
 某研究性學習小組用電解CuSO4溶液的方法測定銅的相對原子質量(裝置如圖),實驗中測得某電極的質量增重為m g,已知氧元素相對原子質量為16.請回答:
某研究性學習小組用電解CuSO4溶液的方法測定銅的相對原子質量(裝置如圖),實驗中測得某電極的質量增重為m g,已知氧元素相對原子質量為16.請回答:查看答案和解析>>
科目: 來源: 題型:
 ⑦O2和O3 ⑧CH3CH(CH3)CH3和CH(CH3)3 ⑨金剛石和石墨.
⑦O2和O3 ⑧CH3CH(CH3)CH3和CH(CH3)3 ⑨金剛石和石墨.查看答案和解析>>
科目: 來源: 題型:
 (1)如圖所示裝置,回答下列問題鹽橋中陰離子移向
(1)如圖所示裝置,回答下列問題鹽橋中陰離子移向
| ||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com