
科目: 來源:不詳 題型:實驗題
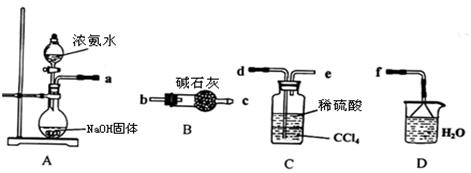
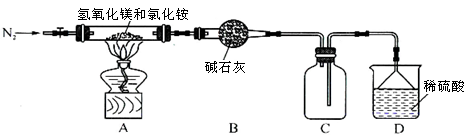
查看答案和解析>>
科目: 來源:不詳 題型:填空題
 C(g)+D(g)反應的平衡常數和溫度的關系如下:
C(g)+D(g)反應的平衡常數和溫度的關系如下:| |溫度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常數的值為 。
A(g)+B(g)的平衡常數的值為 。查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.CaCO3(s) =CaO(s)+CO2(g)室溫下不能自發進行,說明該反應的△H<0 |
| B.鍍銅鐵制品鍍層受損后,鐵制品比受損前更容易生銹 |
| C.N2(g)+3H2(g) =2NH3(g) △H<0,其他條件不變時升高溫度,反應速率v(H2 )和H2的平衡轉化率均增大 |
| D.水的離子積常數Kw 隨著溫度的升高而增大,說明水的電離是放熱反應 |
查看答案和解析>>
科目: 來源:不詳 題型:問答題
| 反應過程 | 化學方程式 | 焓變△H (kJ/mol) | 活化能Ea (kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | 165.0 | 243.9 |
 CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。 CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;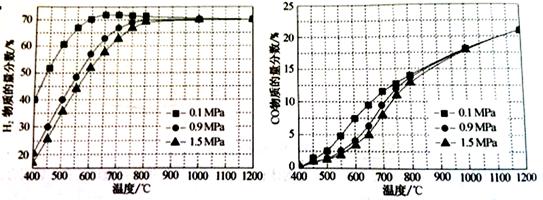
查看答案和解析>>
科目: 來源:不詳 題型:單選題
 2NH3(g),△H=-92.4 kJ·mol-1下列敘述正確的是
2NH3(g),△H=-92.4 kJ·mol-1下列敘述正確的是| A.達到化學平衡時,若升高溫度,則正反應速率減小,逆反應速率增大 |
| B.若單位時間內消耗x mol N2,同時生成2x mol NH3,則反應達到平衡狀態 |
| C.達到平衡后,將容器體積減小為原來的一半,重新達到平衡后,c(NH3)變為原平衡時的2倍 |
| D.若達到平衡時,共放出46.2kJ熱量,則有l mo1NH3(g)生成 |
查看答案和解析>>
科目: 來源:不詳 題型:問答題
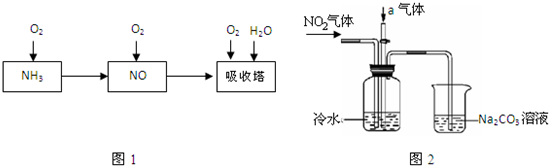
 N2O4(g)的平衡常數K= ,若NO2起始濃度為2mol/L,相同條件下,NO2的最大轉化率為 。
N2O4(g)的平衡常數K= ,若NO2起始濃度為2mol/L,相同條件下,NO2的最大轉化率為 。查看答案和解析>>
科目: 來源:不詳 題型:問答題
 CO2(g)+H2(g) ΔH=Q,其平衡常數隨溫度變化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常數隨溫度變化如下表所示:| 溫度/℃ | 400 | 500 | 850 |
| 平衡常數 | 9.94 | 9 | 1 |
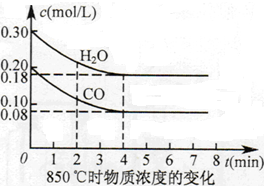
查看答案和解析>>
科目: 來源:不詳 題型:填空題
 CH3OH(g)。工業上依此用CO生產燃料甲醇。
CH3OH(g)。工業上依此用CO生產燃料甲醇。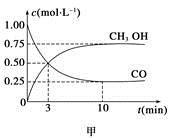
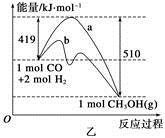
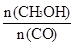 增大的有____________。
增大的有____________。查看答案和解析>>
科目: 來源:不詳 題型:單選題
A.在固定體積的密閉容器中發生可逆反應A(s)+B(g)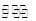 C(g)+D(g),當混合氣體的密度不再改變時,說明已達到化學平衡狀態 C(g)+D(g),當混合氣體的密度不再改變時,說明已達到化學平衡狀態 |
B.對于反應C(s)+CO2(g)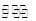 2CO(g)△H>0,改變某一條件,若化學平衡常數增大,則反應速率也一定增大 2CO(g)△H>0,改變某一條件,若化學平衡常數增大,則反應速率也一定增大 |
C.向0.1mol·L-1的NH3·H2O中加入氯化銨固體,則溶液中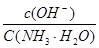 增大 增大 |
D.常溫下向Mg(OH)2懸濁液中加入MgCl2濃溶液后,溶液中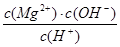 不變 不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com