
 CO2(g)+H2(g) ΔH=Q,其平衡常數隨溫度變化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常數隨溫度變化如下表所示:| 溫度/℃ | 400 | 500 | 850 |
| 平衡常數 | 9.94 | 9 | 1 |
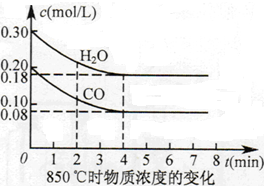
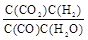 <
<  ,隨溫度升高,平衡常數減小,說明升溫平衡向逆移動,正反應是放熱反應,Q <0。
,隨溫度升高,平衡常數減小,說明升溫平衡向逆移動,正反應是放熱反應,Q <0。

 開心練習課課練與單元檢測系列答案
開心練習課課練與單元檢測系列答案科目:高中化學 來源:不詳 題型:問答題
 H2(g)十I2 △H>0。若在一定條件下密閉容器中加入l mol HI(g), n(H2)隨時間(t)的變化如圖所示:
H2(g)十I2 △H>0。若在一定條件下密閉容器中加入l mol HI(g), n(H2)隨時間(t)的變化如圖所示: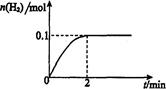
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2C(氣),平衡時C的體積分數與溫度和壓強的關系如圖所示,下列判斷正確的是
2C(氣),平衡時C的體積分數與溫度和壓強的關系如圖所示,下列判斷正確的是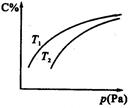
| A.若正反應方向ΔH<0,則T1>T2 |
| B.壓強增大時,混合氣體的平均相對分子質量減小 |
| C.B一定為氣體 |
| D.A一定為氣體 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
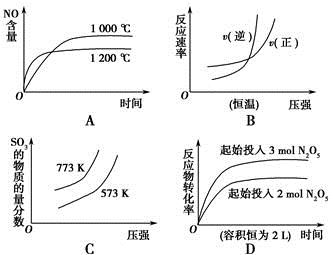
A.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g) ΔH=-b kJ·mol-1 2NH3(g) ΔH=-b kJ·mol-1 |
C.2SO3(g)  2SO2(g)+O2(g) ΔH=+c kJ·mol-1 2SO2(g)+O2(g) ΔH=+c kJ·mol-1 |
D.2N2O5(g)  4NO2(g)+O2(g) ΔH=+d kJ·mol-1 4NO2(g)+O2(g) ΔH=+d kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
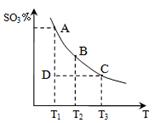
 2SO3(g)的△H____0(填“>”或“<”),若在恒溫、恒壓條件下向上述平衡體系中通入氦氣,平衡 移動(填“向左”、“向右”或“不移動”);
2SO3(g)的△H____0(填“>”或“<”),若在恒溫、恒壓條件下向上述平衡體系中通入氦氣,平衡 移動(填“向左”、“向右”或“不移動”); 2CO2+N2。它的優點是 ;
2CO2+N2。它的優點是 ;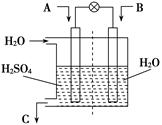
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.CaCO3(s) =CaO(s)+CO2(g)室溫下不能自發進行,說明該反應的△H<0 |
| B.鍍銅鐵制品鍍層受損后,鐵制品比受損前更容易生銹 |
| C.N2(g)+3H2(g) =2NH3(g) △H<0,其他條件不變時升高溫度,反應速率v(H2 )和H2的平衡轉化率均增大 |
| D.水的離子積常數Kw 隨著溫度的升高而增大,說明水的電離是放熱反應 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 CO2(g)+H2(g),有如下數據:
CO2(g)+H2(g),有如下數據:| 實驗 | 溫度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0 2N2(g)+CO2(g)+2H2O(g) △H2<0
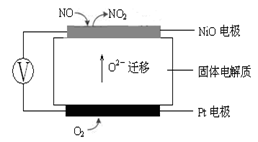
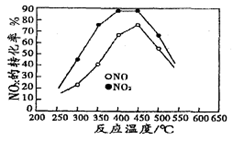
2N2(g)+CO2(g)+2H2O(g) △H2<0 N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)| 投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2NH3(g) ΔH<0。下列研究目的和圖示相符的是
2NH3(g) ΔH<0。下列研究目的和圖示相符的是| | A | B | C | D |
| 研究 目的 | 溫度(T)對反應的影響(T2>T1) | 壓強(p)對平衡常數的影響 | 溫度(T)對反應的影響 | 壓強(p)對反應的影響(p2>p1) |
| 圖示 | 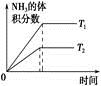 |  | 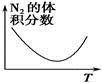 |  |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com