
分析 (1)②中Fe元素的化合價降低;
(2)使食物中的Fe3+還原成Fe2+,Fe元素的化合價降低,則維生素C中某元素的化合價升高;
(3)鐵粉在人體胃酸的作用下轉化成亞鐵鹽,還生成氫氣;
(4)金屬鐵能被磁鐵吸引,可以用來檢驗金屬鐵的存在.
解答 解:(1)②中Fe元素的化合價降低,則,②中的Fe3+作氧化劑,故答案為:氧化;
(2)使食物中的Fe3+還原成Fe2+,Fe元素的化合價降低,則維生素C中某元素的化合價升高,所以維生素C作還原劑,具有還原性,故答案為:還原;還原;
(3)鐵粉在人體胃酸的作用下轉化成亞鐵鹽,還生成氫氣,該離子反應為Fe+2H+═Fe2++H2↑,故答案為:Fe+2H+═Fe2++H2↑;
(4)證明該麥片中含有微量的顆粒細小的還原鐵粉可以:取少量麥片于燒杯中加水溶解并過濾,有微量的細小顆能被磁鐵吸引,故答案為:取少量麥片于燒杯中加水溶解并過濾,有微量的細小顆能被磁鐵吸引.
點評 本題考查氧化還原反應,為高考常考考點,明確反應中元素的化合價變化是解答的關鍵,側重基本概念的考查,題目難度不大.


 同步輕松練習系列答案
同步輕松練習系列答案 課課通課程標準思維方法與能力訓練系列答案
課課通課程標準思維方法與能力訓練系列答案科目:高中化學 來源: 題型:選擇題
| 所含離子 | NO3- | SO42- | H+ | M |
| 濃度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | H+ | D. | S2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應放出的熱量為0.08akJ | |
| B. | 平衡時H2O的轉化率為CO轉化率的一半 | |
| C. | 若改變條件,K增大則壓強增大 | |
| D. | 將容器的體積壓縮為1L,該平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 保持溫度和活塞位置不變,在甲中再加入1 mol A和2 mol B,達到新的平衡后,甲中C的濃度是乙中C的濃度的2倍 | |
| B. | 保持溫度不變,移動活塞P,使乙的容積和甲相等,達到新的平衡后,乙中C的體積分數是甲中C的體積分數的2倍 | |
| C. | 保持溫度和乙中的壓強不變,t2時分別向甲、乙中加入等質量的氦氣后,甲、乙中反應速率變化情況分別如圖2和圖3所示(t1前的反應速率變化已省略) | |
| D. | 保持活塞位置不變,升高溫度,達到新的平衡后,甲中B的體積分數增大,乙中B的體積分數減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
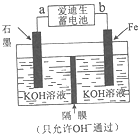 中國是世界上第一鋼鐵生產大國,近兩年鋼鐵行業形式急轉直下,不少鋼鐵企業陷入全面虧損,2015年,鋼鐵年產量出現34年來的首次下降.原因就是因為高爐煉鐵技術低級落后,不能生產高附加值產品.請根據所學知識回答下列問題:
中國是世界上第一鋼鐵生產大國,近兩年鋼鐵行業形式急轉直下,不少鋼鐵企業陷入全面虧損,2015年,鋼鐵年產量出現34年來的首次下降.原因就是因為高爐煉鐵技術低級落后,不能生產高附加值產品.請根據所學知識回答下列問題:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
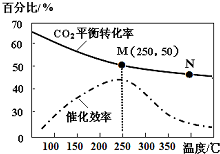 綜合利用CO2、CO對構建低碳社會有重要意義.
綜合利用CO2、CO對構建低碳社會有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K越大,反應程度越大 | B. | K越大,反應程度越小 | ||
| C. | K的大小與反應程度無關 | D. | 升高溫度,K增大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com