
| 序號 | 反應物 | 產物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第①組反應的其余產物為H20 | |
| B. | 第②組反應中CI2與FeBr2的物質的量之比小于或等于1:2 | |
| C. | 第③組反應中生成1mol Cl2,轉移電子5 mol | |
| D. | 氧化性由強到弱順序為Mn04->Cl2>Fe3+>Br2 |
分析 依據氧化還原反應中原子守恒,電子守恒和電荷守恒分析配平化學方程式判斷選項;
A、錳元素化合價降低,過氧化氫中氧元素化合價升高生成氧氣;
B、亞鐵離子還原性大于溴離子,產物說明氯氣反應過程中亞鐵離子全部氧化,溴離子部分氧化;
C、依據反應2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2O,計算電子轉移;
D、氧化還原反應中氧化劑的氧化性大于氧化產物分析判斷.
解答 解:A、錳元素化合價降低,過氧化氫中氧元素化合價升高生成氧氣,2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑,故A錯誤;
B、3C12+6FeBr2=2FeC13+4FeBr3 ,亞鐵離子還原性大于溴離子,產物說明氯氣反應過程中亞鐵離子全部氧化,溴離子部分氧化,Cl2與FeBr2的物質的量之比小于或等于1:2,故B正確;
C、2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2O,生成5mol Cl2,轉移電子10mol,故C錯誤;
D、氧化劑的氧化性大于氧化產物,依據化學方程式分析判斷,氧化性由強到弱順序為MnO4->Cl2>Br2>Fe3+,故D錯誤;
故選B.
點評 本題考查了氧化還原反應反應實質、電子轉移的計算應用,主要是反應產物的判斷,掌握離子性質和氧化還原反應規律應用是解題關鍵,題目難度中等.


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | HNO3在反應中既表現氧化性也表現出酸性 | |
| B. | 每生成22.4 L NO(標準狀況)有3 mol電子轉移 | |
| C. | HNO3作氧化劑,銅作還原劑,3 mol Cu還原8 mol的HNO3 | |
| D. | HNO3作氧化劑,銅作還原劑,3 mol Cu還原2 mol的HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
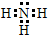 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

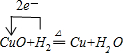
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應中維生素C作還原劑 | |
| B. | 河蝦與其它含維生素C較多蔬菜也不宜同食 | |
| C. | 河蝦與西紅柿同食發生了氧化還原反應 | |
| D. | 該反應中砷元素被氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D為原子序數依次增大的四種元索,A2-和B+具有相同的電子構型;C、D為同周期元索,C核外電子總數是最外層電子數的3倍;D元素最外層有一個未成對電子.回答下列問題:
A、B、C、D為原子序數依次增大的四種元索,A2-和B+具有相同的電子構型;C、D為同周期元索,C核外電子總數是最外層電子數的3倍;D元素最外層有一個未成對電子.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
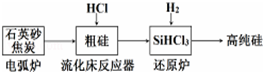
| 發生的主要反應 | |
| 電弧爐 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$si+2CO |
| 流化床反應器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 還原爐 |
| 物質 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸點/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com