
【題目】在恒容密閉容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他條件不變的情況下,研究溫度對反應的影響,實驗結果如圖所示,下列說法正確的是
CH3OH(g),在其他條件不變的情況下,研究溫度對反應的影響,實驗結果如圖所示,下列說法正確的是
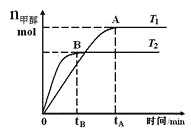
A. 平衡常數K=![]()
B. 該反應在T1時的平衡常數比T2時的小
C. CO合成甲醇的反應為吸熱反應
D. 處于A點的反應體系從T1變到T2,達到平衡時![]() 增大
增大
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】在T℃時,AgBr在水中的沉淀溶解平衡曲線如圖所示。又知T℃時AgCl的Ksp=2×10 -10,下列說法不正確的是( )
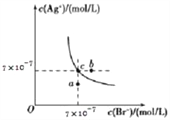
A. 在T℃時,AgBr的Ksp為4.9×10-13
B. 在AgBr的飽和溶液中加入NaBr固體,可使溶液由c點到b點
C. 圖中a點對應的是含AgBr的不飽和溶液
D. 在T℃時,AgCl(s)+Br -(aq)![]() AgBr(s)+Cl -(aq)的平衡常數K≈408
AgBr(s)+Cl -(aq)的平衡常數K≈408
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗小組的同學為探究和比較SO2和氯水的漂白性,設計了如下的實驗裝置.
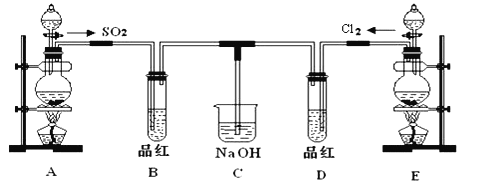
(1)實驗室用裝置A制備SO2某同學在實驗時發現打開A的分液漏斗活塞后,漏斗中液體未流下,你認為原因可能是__________.
(2)實驗室用裝置E制備Cl2,其反應的化學方程式為__________;若有8mol的HCl參加反應,則轉移的電子總數為__________.
(3)該裝置中氫氧化鈉溶液的作用是__________
(4)通氣后B、D兩個試管中的現象分別為B:________D:________.停止通氣后,再給B、D兩個試管分別加熱,兩個試管中的現象分別為B:______________D:___________.
(5)另一個實驗小組的同學認為SO2和氯水都有漂白性,二者混合后的漂白性肯定會更強.他們將制得的SO2和Cl2按1:1同時通入到品紅溶液中,結果發現品紅的顏色_________.請你分析該現象的原因(用化學方程式表示)__________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知299 K時,合成氨反應N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,將此溫度下的1 mol N2和3 mol H2放在一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量為(忽略能量損失)
2NH3( g ) △H =" -92.0" kJ/mol,將此溫度下的1 mol N2和3 mol H2放在一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量為(忽略能量損失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】框圖中甲、乙為單質,其余均為化合物,B為常見液態化合物,A為淡黃色固體,F、G所含元素相同且均為氯化物,G遇KSCN溶液顯紅色。
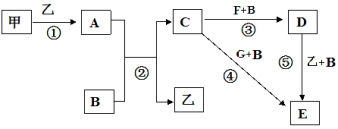
請問答下列問題:
(1)反應①-⑤中,既屬于氧化還原反應又屬于化合反應的是______________(填序號)。
(2)反應⑤的化學方程式為____________________________。
(3)甲與B反應的離子方程式 ______________________________。
(4)在實驗室將C溶液滴入F溶液中,觀察到的現象是_____________。
(5)在F溶液中加入等物質的量的A,發生反應的總的離子方程式為:___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。右圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:

(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則
①電解池中X極上的電極反應式為 。在X極附近觀察到的現象是 。
②Y電極上的電極反應式為 ,檢驗該電極反應產物的方法是 。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
①X電極的材料是 ,電極反應式是 。
②Y電極的材料是 ,電極反應式是 。
(說明:雜質發生的電極反應不必寫出)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳和碳的化合物在生產、生活中的應用非常廣泛。 現將不同量的CO2(g)和H2(g)分別通入體積為2L的恒容密閉容器中,進行如下反應:CO2(g)+H2(g)![]() [Failed to download image : ]CO(g)+H2O(g),得到如下三組數據:
[Failed to download image : ]CO(g)+H2O(g),得到如下三組數據:
實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

(1)實驗1中,平衡常數K=0.9;v(H2)=0.15mol/(Lmin)該反應的正反應為______(填“吸”或“放”)熱反應;
(2)實驗3跟實驗2相比,改變的條件可能是___________________________
(答一種情況即可);若該反應符合圖所示的關系,則在圖中Y軸表示___________________________
(3)能判斷該反應達到化學平衡狀態的依據是______(多選扣分).
a.容器中壓強不變 b.混合氣體中c(CO )不變
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某溫度下,平衡濃度符合下式:c(CO2)c(H2)=c(CO)c(H2O)由此可以判斷此時的溫度為______.其它條件不變,升高溫度,原化學平衡向______反應方向移動(填“正”或“逆”),容器內混合氣體的密度______(填“增大”、“減小”或“不變”).
(5)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需要0.80 mol·L-1 NaOH溶液475 mL 和0.40 mol·L-1硫酸500 mL。根據這兩種溶液的配制情況回答下列問題:
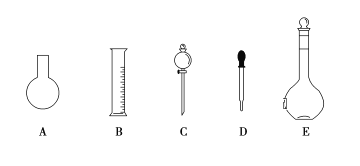
(1)如圖所示的儀器中配制溶液肯定不需要的是____________(填序號),配制上述溶液還需用到的玻璃儀器是____________________(填儀器名稱)。
(2)容量瓶所不具備的功能有________(填序號)。
A.配制一定體積準確濃度的標準溶液
B.量取一定體積的液體
C.測量容量瓶規格以下的任意體積的液體
D.貯存溶液
E.用來加熱溶解固體溶質
(3)根據計算用托盤天平稱取NaOH的質量為___________g。
(4)在實驗中其他操作均正確,若容量瓶用蒸餾水洗滌后未干燥,則所得溶液濃度________0.80 mol·L-1(填“大于”“等于”或“小于”,下同)。若還未等溶液冷卻就定容了,則所得溶液濃度________0.80 mol·L-1。
(5)根據計算得知,所需質量分數為98%、密度為1.84 g·cm-3的濃硫酸的體積為________mL(計算結果保留一位小數)。如果實驗室有10 mL、15 mL、20 mL、50 mL的量筒,最好選用________mL的量筒。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在常溫下,如下圖所示的裝置中,若使活塞下移,重新達到平衡時,下列數值會增大的是

A. 陽離子數目 B. HCO3-的水解平衡常數 C. 溶液的pH D. c(HCO3-)/c(H2CO3)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com