
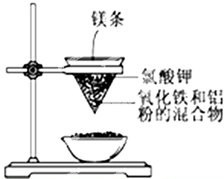
分析 (1)氧化鐵和鋁粉在高溫條件下發生鋁熱反應生成鐵和氧化鋁;
(2)根據化合價變化判斷氧化劑、還原劑;
(3)根據鋁熱反應的反應現象“反應放出大量的熱,并發出耀眼的光,紙漏斗的下部被燒穿,有熔融物落入沙中”等現象進行判斷;
(4)利用鋁熱反應可以冶煉金屬、焊接鋼軌;
(5)鋁粉與二氧化錳在高溫下反應生成氧化鋁和錳,據此寫出反應方程式.
解答 解:(1)氧化鐵和鋁粉在高溫條件下發生鋁熱反應生成鐵和氧化鋁,反應的化學方程式為:Fe2O3+2Al$\frac{\underline{\;高溫\;}}{\;}$Al2O3+2Fe,
故答案為:Fe2O3+2Al$\frac{\underline{\;高溫\;}}{\;}$Al2O3+2Fe;
(2)該反應中Fe2O3化合價降低被還原,作氧化劑;Al的化合價升高被氧化,作還原劑,該反應為鋁熱反應,
故答案為:Fe2O3;Al;
(3)該反應在高溫條件下進行,反應的現象有:鎂條劇烈燃燒、放出大量的熱,并發出耀眼的光芒,火星四射、紙漏斗的下部被燒穿、有紅熱狀態的液珠落入蒸發皿內的細沙上,液珠冷卻后變為黑色固體,所以①②③④都正確,
故答案為:①②③④;
(4)鋁熱法是一種利用鋁的還原性獲得高熔點金屬單質的方法,重要用途有:冶煉金屬、焊接鋼軌等,
故答案為:冶煉金屬、焊接鋼軌;
(5)鋁粉與二氧化錳在高溫下反應生成氧化鋁和金屬錳,反應的化學方程式為:3MnO2+4Al$\frac{\underline{\;高溫\;}}{\;}$2Al2O3+3Mn,
故答案為:3MnO2+4Al$\frac{\underline{\;高溫\;}}{\;}$2Al2O3+3Mn.
點評 本題考查了鋁熱反應原理及其應用,題目難度中等,注意掌握鋁熱反應發生原理、反應裝置及正確的操作方法,明確鋁熱反應的現象及用途,試題培養了學生的分析能力及靈活應用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | K1>K2 | B. | K1<K2 | ||
| C. | K1=K2 | D. | 視溶液的酸堿性而定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
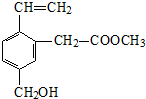
| A. | 能發生水解反應 | B. | 能發生酯化反應 | ||
| C. | 不易溶于水 | D. | 不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,16g甲烷所含的質子數為10NA | |
| B. | 常溫常壓下,18g重水所含的原子數為3NA | |
| C. | 標準情況下,22.4L四氯化碳所含有的分子數為NA | |
| D. | 常溫常壓下,1mol氦氣分子所含有的核外電子數為4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯使溴水褪色的反應方程式是:CH2═CH2+Br2→CH3CHBr2 | |
| B. | HOCH2CH2COOH可以發生取代反應 | |
| C. | 煤干餾可得到大量汽油和煤油 | |
| D. | 淀粉(C6H10O5)n和纖維素(C6H10O5)n互為同分異構體,其水解產物都能與新制Cu(OH)2反應生成磚紅色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
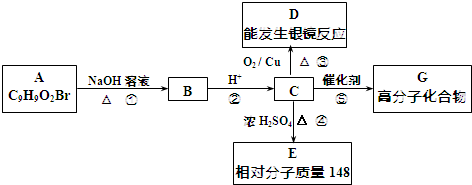
 .
.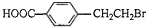 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.反應⑤的化學方程式是
+NaBr+H2O.反應⑤的化學方程式是 .
.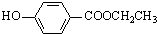 、
、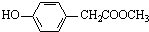 、還有4種.
、還有4種.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14.6g | B. | 7.3g | C. | 3.65g | D. | 0.73g |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 用飽和的Na2SO4溶液使雞蛋清發生鹽析,進而分離、提純蛋白質 | |
| B. | 淀粉和纖維素的組成都可用(C6H10O5)n表示,它們互為同分異構體 | |
| C. | 苯酚與苯甲酸都能發生加成反應和取代反應 | |
| D. | 汽油和植物油都是碳氫化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com